题目内容
一化学小组为了测定某铜矿中碱式碳酸铜[Cu2(OH)2CO3]的质量分数.称取该铜矿样品30g于烧杯中,逐滴滴入质量分数为10%的稀盐酸至刚好完全反应,共用去稀盐酸146g.(假设铜矿中的杂质不与稀盐酸反应,也不溶于水)
试求:
(1)稀盐酸中HCl的质量是多少克?
(2)铜矿中碱式碳酸铜的质量是多少克?其质量分数是多少?
(3)反应后所得氯化铜溶液中溶质的质量分数是多少?
(反应的化学方程式为:Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O.反应中各物质的相对分子质量:Cu2(OH)2CO3~222
HCl~36.5 CuCl2~135 CO2~44 H2O~18)
稀盐酸中HCl的质量分数为14.6克;铜矿中碱式碳酸铜的质量是22.2克,质量分数为74%;反应后溶液的溶质的质量分数为16.5%.
解析试题分析:(1)稀盐酸中HCl的质量=146克×10%=14.6克.
(2)设铜矿中碱式碳酸铜的质量为X,生成的氯化铜的质量为Y,二氧化碳的质量为Z.
Cu2(OH)2CO3+4HCl═2CuCl2+CO2↑+3H2O
222 146 270 44
X 14.6克 Y Z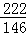 ═
═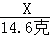
得:X═22.2克 ═
═
y═27克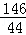 ═
═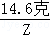
得:Z=4.4克
∴铜矿中碱式碳酸铜的质量分数=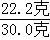 ×100%═74%.
×100%═74%.
(3)根据(2)计算可知,反应后溶液的质量=22.2克+146克﹣4.4克=163.8克.
∴反应后所得溶液的质量分数=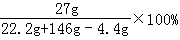 =16.5%.
=16.5%.
答:稀盐酸中HCl的质量分数为14.6克;铜矿中碱式碳酸铜的质量是22.2克,质量分数为74%;反应后溶液的溶质的质量分数为16.5%.
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算.

 名校课堂系列答案
名校课堂系列答案目前市场上的补钙药剂很多,下图是某品牌补钙药品的部分说明书。为测定其含量是否达标,某兴趣小组的同学取10片钙片研碎后放于烧杯中,将100g稀盐酸分五次加入到烧杯中,并不断搅拌,称量,将得到的有关数据记录如下(钙片中其它成分不与稀盐酸反应):
| XXX钙片 [药品规格]每片1g [药品含量]含CaCO380% [用法用量]每次一片,每天2次 |
| 加入稀盐酸的质量/g | 0 | 20 | 40 | 60 | 80 | 100 |
| 烧杯中剩余物质质量/g | 10 | 29.12 | 48.24 | 67.36 | 86.48 | 106.48 |
请你根据题给信息和表中数据,回答下列问题:
(1)实验过程中将钙片研碎的目的是: 。
(2)完全反应后,产生二氧化碳的质量为 g
(3)试通过计算说明,该品牌钙片含量是否达标。
(4)如果按用量服用,服用者每天通过该补钙剂摄入钙元素的质量为 g
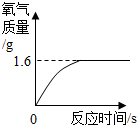
如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去)。
(1)计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)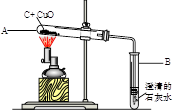
(2)实验前后分别称量了装置A和装置B的质量如表中所示。若数据Ⅰ准确,请回答:
a反应后A中固体的成分是_ 。
b数据Ⅱ存在的问题是_ ,可能的原因是 。
| | 反应前质量(g) | 反应后质量(g) | |
| Ⅰ | 装置A | 125.3 | 124.2 |
| Ⅱ | 装置B | 152 | 152.3 |

 Ti + 2MgCl2,若要制得96 g钛,计算至少需要镁的质量。
Ti + 2MgCl2,若要制得96 g钛,计算至少需要镁的质量。