题目内容
下图是某药厂生产补钙剂的商品标签图。
| XXX儿童咀嚼片(60片装) |
| [主要成分]:碳酸钙、维生素 [功效]:补钙 [规格]:2.5g/片、每片中含:碳酸钙≥25%、维生素D:100IU [食用方法]:嚼食、每日一片 |
请你根据以上标标签信息完成下列计算
(1)主要成分碳酸钙的相对分子质量为 ;每片药剂中至少含钙元素的质量为 克。
(2)小红同学为测定其碳酸钙的含量标注是否属实。她取出4片研碎后放入烧杯中,逐滴加入稀盐酸至不再放出气体为止。共用去稀盐酸40g。称量烧杯中剩余物的质量为47.8g(不含烧杯质量,假定钙片其他成分不与盐酸反应。)求:
① 生成二氧化碳的质量
② 通过计算判断每片钙片中碳酸钙的含量是否属实[CaCO3+2HCl=CaCl2+H2O+CO2↑]
(1)100 0.25
(2)① 2.2g 属实
解析试题分析:(1)根据化学式计算,碳酸钙的相对分子质量=40+12+16×3=100
从标签上的药品规格看[规格]:2.5g/片、每片中含:碳酸钙≥25%,每片药剂中碳酸钙的质量="2.5g×25%=0.625g" ,再根据元素质量=物质的质量×元素的质量分数,在碳酸钙中钙元素的质量分数=40/40+12+16×3×100%=40%,∴每片药剂中至少含钙元素的质量=0.625g×40%=0.25g
(2)根据质量守恒定律,参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,反应前4片钙片,结合标签,即10克,加上逐滴加入稀盐酸至不再放出气体为止。共用去稀盐酸40g,即反应前总质量为50g,反应后称量烧杯中剩余物的质量为47.8g,所以根据质量守恒定律,二氧化碳质量=4×2.5g+40g-47.8g=2.2g,再根据化学方程式:CaCO3+ 2HCl=CaCl2+H2O+CO2↑中碳酸钙与二氧化碳的质量比,结合二氧化碳的质量,可求出样品中碳酸钙的质量。进而可以判断每片钙片中碳酸钙的含量是否属实
解,设4片钙片样品中碳酸钙的质量为x
CaCO3+ 2HCl=CaCl2+H2O+CO2↑
100 44
x 2.2g
100:44=x:2.2g
解得,x ="5g"
所以,钙片样品中碳酸钙的质量分数=5g/10g×100%=50% >25%
考点:根据化学反应方程式的计算

 春雨教育同步作文系列答案
春雨教育同步作文系列答案如图所示,将0.1mol氧化铜与一定量的碳混合加热,充分反应(试管中的空气已被除去)。
(1)计算该实验最多可以生成多少克二氧化碳?(请根据化学方程式列式计算)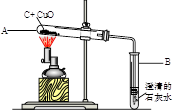
(2)实验前后分别称量了装置A和装置B的质量如表中所示。若数据Ⅰ准确,请回答:
a反应后A中固体的成分是_ 。
b数据Ⅱ存在的问题是_ ,可能的原因是 。
| | 反应前质量(g) | 反应后质量(g) | |
| Ⅰ | 装置A | 125.3 | 124.2 |
| Ⅱ | 装置B | 152 | 152.3 |
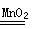 2H2O+O2↑)
2H2O+O2↑) Ti + 2MgCl2,若要制得96 g钛,计算至少需要镁的质量。
Ti + 2MgCl2,若要制得96 g钛,计算至少需要镁的质量。