题目内容
【题目】碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(![]() )而泛黄变质。实验小组为探究碘化钾变质原理,进行如下活动。
)而泛黄变质。实验小组为探究碘化钾变质原理,进行如下活动。
(查阅资料)I.对于碘化钾变质的原理,有两种不同的反应:
甲:![]() ; 乙:
; 乙:![]() 。
。
Ⅱ.![]() 与
与![]() 都属于碱,二者的化学性质相似。
都属于碱,二者的化学性质相似。
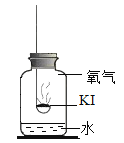
(进行实验)实验1:探充变质的原理
取适量碘化钾固体暴露于空气一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是____
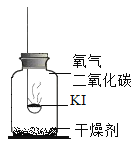
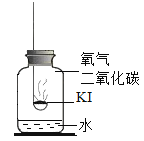
(进行实验)实验2:探究变质的条件
分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮,表面变微黄 | 固体无明显现象 | 固体变潮,无其他明显现象 | 固体变潮,表面变黄 |
(解释与结论)
(2)从上述实验可推知,KI变质的条件是________。
(提出问题)CO2的作用是什么?
(进行实验)
分别取10mL同浓度的KI溶液于3支试管中(试管编号1,2,3),再向试管2中通入CO2,向试管3中滴加几滴盐酸,分别用pH试纸测定溶液的pH;几分钟后,观察溶液的颜色。实验现象记录如下:
td style="width:113.7pt; border-style:solid; border-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">pH=8
试管序号 | 1 | 2 | 3 |
溶液pH | pH=6 | pH=4 | |
溶液颜色 | 无色 | 浅黄色 | 黄色 |
(解释与结论)(3)①pH试纸的使用方法是_______
②CO2在KI变质过程中的作用是________。
(反思与评价)
(4)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是_______
【答案】无法判断K2CO3是按反应甲原理产生的,还是按反应乙原理生成的KOH又与空气中二氧化碳反应生成K2CO3 H2O和O2同时存在 用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比 提供酸性环境,加快KI变质 氮气和稀有气体的化学性质稳定
【解析】
(1)碘化钾直接变质可以生成碳酸钾,或碘化钾变质生成的氢氧化钾,吸收二氧化碳也会生成碳酸钾,通过澄清石灰水变浑浊的现象,不能判断碳酸钾是如何转化成的;
故填:无法判断K2CO3是按反应甲原理产生的,还是按反应乙原理生成的KOH又与空气中二氧化碳反应生成K2CO3。
(2)从上述实验可推知,KI变质的条件是:H2O和O2同时存在;故答案为:H2O和O2同时存在.
(3)①pH试纸的使用方法是:用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比;
故填:用洁净干燥的玻璃棒蘸取少量反应后的溶液滴在干燥的pH试纸上,观察颜色变化并与标准比色卡对比。
②CO2在KI变质过程中的作用是提供酸性环境,加快KI变质。
故填:提供酸性环境,加快KI变质。
(6)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是氮气和稀有气体的化学性质稳定。
故填:氮气和稀有气体的化学性质稳定。

【题目】甲乙丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸完全反应,所得数据如下表:
甲 | 乙 | 丙 | |
金属混合物的质量(g) | 10 | 10 | 20 |
稀硫酸的质量(g) | 100 | 120 | 100 |
反应后,过滤所得干燥固体的质量(g) | 4.4 | 4.4 | 14.4 |
请计算:
(1)_______中铁和稀硫酸恰好完全反应
(2)金属混合物中铁的质量分数为________。
(3)计算铁和稀硫酸恰好完全反应时生成物的溶液中溶质的质量分数(精确到0.1%)________。
【题目】测定某品牌洁厕灵中硫酸质量。取20g该品牌的洁厕灵溶液于烧杯中,不断滴加25g溶质质量分数为17.1%的氢氧化钡溶液,反应过程中滴入氢氧化钡溶液的质量和烧杯中溶液pH变化的部分数据如下所示:
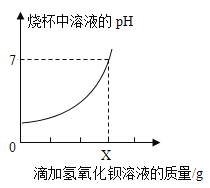
滴加氢氧化钡溶液的质量/g | 5 | 10 | X | 25 |
烧杯中产生沉淀的质量/g | 1.165 | 2.33 | 4.66 | 4.66 |
求:
①当烧杯中溶液的pH=7时,加入氢氧化钡溶液质量X=______g。
②测得20g该品牌的洁厕灵溶液中硫酸的质量是______g。(根据化学方程式计算)
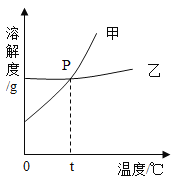
【题目】常温下,下表物质符合图中转化关系的是( )
选项 | 甲 | 乙 | 丙 | 转化关系图 |
A | CaCO3 | Ca(OH)2 | CaCl2 |
|
B | CuO | H2O | O2 | |
C | NaCl | NaNO3 | NaOH | |
D | CO2 | H2O | H2CO3 |
A.AB.BC.CD.D
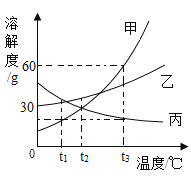
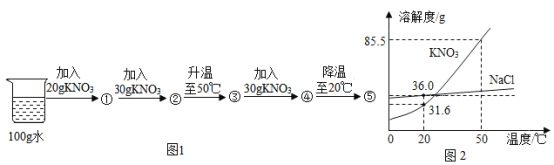
【题目】NaCl 和KNO3在不同温度时的溶解度如下,回答下列问题。
温度/℃ | 0 | 10 | 20 | 30 | 40 | 50 | 60 | |
溶解度/g | NaCl | 35.7 | 35.8 | 36.0 | 36.3 | 36.6 | 37.0 | 37.3 |
KNO3 | 13.3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110 | |
(1)10℃时,在100 g水里溶解_________g KNO3时,溶液恰好达到饱和状态。
(2)右图为NaCl 和KNO3的溶解度曲线,则表示NaCl的溶解度曲线是_________(填“甲”或“乙”);其中温度t的范围可能在________(填字母序号)。
A.10℃~20℃ B.20℃~30℃
C.30℃~40℃ D.40℃~50℃
(3)10℃时,分别在100 g水中加入35 g NaCl 和KNO3固体,加热到60℃时,NaCl溶液为__________(填“饱和”或“不饱和”)溶液。加热前后,有关两溶液的说法正确的是____________(填字母序号)。
A.10℃时,两溶液中溶质的质量分数相同
B.60℃时,两溶液中溶质的质量分数相同
C.加热前后,NaCl溶液中溶质的质量分数不变
D.加热前后,KNO3溶液中溶质的质量分数不变