题目内容
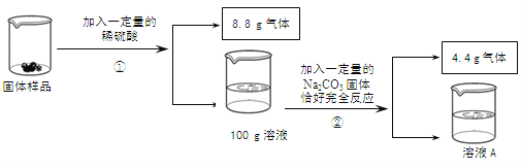
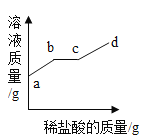
【题目】甲乙丙三位同学分别取铁粉和铜粉的均匀混合物与某稀硫酸完全反应,所得数据如下表:
甲 | 乙 | 丙 | |
金属混合物的质量(g) | 10 | 10 | 20 |
稀硫酸的质量(g) | 100 | 120 | 100 |
反应后,过滤所得干燥固体的质量(g) | 4.4 | 4.4 | 14.4 |
请计算:
(1)_______中铁和稀硫酸恰好完全反应
(2)金属混合物中铁的质量分数为________。
(3)计算铁和稀硫酸恰好完全反应时生成物的溶液中溶质的质量分数(精确到0.1%)________。
【答案】甲 56% 14.4%
【解析】
(1)由甲和乙对比可知,乙中稀硫酸过量,由甲和丙对比可知,丙中混合物过量,因此甲中铁和稀硫酸恰好完全反应,因此应该用甲中数据进行计算。
(2)甲中反应后,过滤得干燥固体质量是铜的质量,即铜的质量是4.4g,则金属混合物中铁的质量=10g-4.4g=5.6g。金属混合物中铁的质量分数=![]() ;
;
(3)设:5.6g的铁与100g稀硫酸完全反应生成氢气的质量为x,硫酸亚铁的质量为y。。
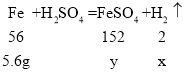
![]() x=0.2g;
x=0.2g;
![]() y=15.2g;
y=15.2g;
铁和稀硫酸恰好完全反应时生成物的溶液中溶质的质量分数=![]() 。
。

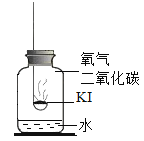
【题目】碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(![]() )而泛黄变质。实验小组为探究碘化钾变质原理,进行如下活动。
)而泛黄变质。实验小组为探究碘化钾变质原理,进行如下活动。
(查阅资料)I.对于碘化钾变质的原理,有两种不同的反应:
甲:![]() ; 乙:
; 乙:![]() 。
。
Ⅱ.![]() 与
与![]() 都属于碱,二者的化学性质相似。
都属于碱,二者的化学性质相似。
(进行实验)实验1:探充变质的原理
取适量碘化钾固体暴露于空气一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是____
(进行实验)实验2:探究变质的条件
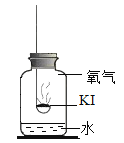
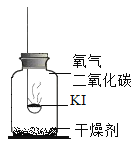
分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮,表面变微黄 | 固体无明显现象 | 固体变潮,无其他明显现象 | 固体变潮,表面变黄 |
(解释与结论)
(2)从上述实验可推知,KI变质的条件是________。
(提出问题)CO2的作用是什么?
(进行实验)
分别取10mL同浓度的KI溶液于3支试管中(试管编号1,2,3),再向试管2中通入CO2,向试管3中滴加几滴盐酸,分别用pH试纸测定溶液的pH;几分钟后,观察溶液的颜色。实验现象记录如下:
试管序号 | 1 | 2 | 3 |
溶液pH | td style="width:113.7pt; border-style:solid; border-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">pH=6 | pH=4 | |
溶液颜色 | 无色 | 浅黄色 | 黄色 |
(解释与结论)(3)①pH试纸的使用方法是_______
②CO2在KI变质过程中的作用是________。
(反思与评价)
(4)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是_______