题目内容
【题目】常温下,下表物质符合图中转化关系的是( )
选项 | 甲 | 乙 | 丙 | 转化关系图 |
A | CaCO3 | Ca(OH)2 | CaCl2 |
|
B | CuO | H2O | O2 | |
C | NaCl | NaNO3 | NaOH | |
D | CO2 | H2O | H2CO3 |
A.AB.BC.CD.D
【答案】D
【解析】
一步反应实现即所涉及物质只发生一个反应即可转化为目标物质,根据所涉及物质的性质,分析能否只通过一个反应而实现转化即可。
A、碳酸钙难溶于水,不能与碱溶液反应,不能一步转化为氢氧化钙,选项A错误。
B、氧化铜与硫酸反应生成硫酸铜和水,水通电生成氢气和氧气,铜在加热条件下能与氧气反应生成氧化铜,常温下铜不与氧气反应,选项B错误。
C、氯化钠能与硝酸银溶液反应生成氯化银沉淀和硝酸钠,硝酸钠转化为氢氧化钠,假设能行,对应的生成物是硝酸盐和氢氧化钠,硝酸盐和氢氧化钠均易溶于水,不符合复分解反应发生的条件,选项C错误。
D、二氧化碳能与氢氧化钠反应生成碳酸钠和水,二氧化碳与水反应生成碳酸,碳酸分解生成水和二氧化碳,符合图中转化关系,选项D正确。
故选D。

 快捷英语周周练系列答案
快捷英语周周练系列答案【题目】碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(![]() )而泛黄变质。实验小组为探究碘化钾变质原理,进行如下活动。
)而泛黄变质。实验小组为探究碘化钾变质原理,进行如下活动。
(查阅资料)I.对于碘化钾变质的原理,有两种不同的反应:
甲:![]() ; 乙:
; 乙:![]() 。
。
Ⅱ.![]() 与
与![]() 都属于碱,二者的化学性质相似。
都属于碱,二者的化学性质相似。
(进行实验)实验1:探充变质的原理
取适量碘化钾固体暴露于空气一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是____
(进行实验)实验2:探究变质的条件
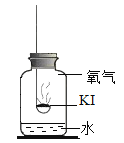
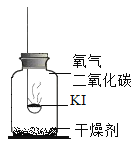
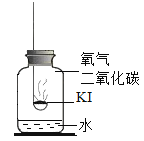
分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮,表面变微黄 | 固体无明显现象 | 固体变潮,无其他明显现象 | 固体变潮,表面变黄 |
(解释与结论)
(2)从上述实验可推知,KI变质的条件是________。
(提出问题)CO2的作用是什么?
(进行实验)
分别取10mL同浓度的KI溶液于3支试管中(试管编号1,2,3),再向试管2中通入CO2,向试管3中滴加几滴盐酸,分别用pH试纸测定溶液的pH;几分钟后,观察溶液的颜色。实验现象记录如下:
试管序号 | 1 | 2 | 3 |
溶液pH | td style="width:113.7pt; border-style:solid; border-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">pH=6 | pH=4 | |
溶液颜色 | 无色 | 浅黄色 | 黄色 |
(解释与结论)(3)①pH试纸的使用方法是_______
②CO2在KI变质过程中的作用是________。
(反思与评价)
(4)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是_______
【题目】实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水;
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分。
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告:
实验操作与现象 | 实验结论 |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O.
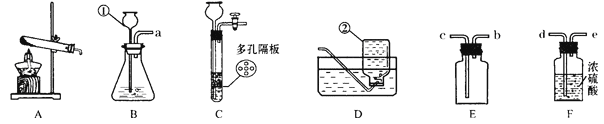
【进行实验】选择如下图所示装置进行验证:
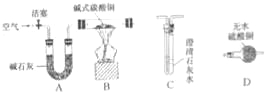
步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→ → (填“C”,“D”);
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO2和H2O,写出装置C中反应的化学方程式 ;
②写出Cu2(OH)2CO3受热分解的化学方程式 。
【反思与评价】
上述装置中A的作用是 。