题目内容
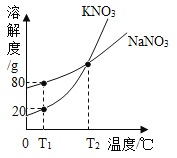
【题目】图1表示向20℃时100g水中加入20g硝酸钾进行的系列实验,①—⑤表示实验所得溶液;图2是NaCl、KNO3的溶解度曲线。
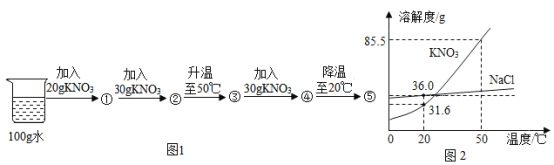
①0℃时溶解度较大的物质是___,20℃时硝酸钾的溶解度是___g/100g水,③是____(填“饱和”或“不饱和”)溶液,其溶质的质量分数为_____(列式即可)。
②50℃时,将接近饱和的硝酸钾溶液变为饱和溶液的方法是______(写一种即可)。
③50℃时,饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1___w2(选填“>”“=”或“<”)。
④已知②→③的过程中有少量水蒸发,下列叙述正确的是____(填序号)。
a.①、②均为不饱和溶液 b.②→③的过程中溶质质量分数变大 c.④→⑤的过程中析出KNO3晶体53.9g
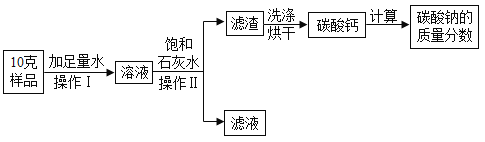
⑤除去KNO3固体中混有的少量NaCl的实验操作为:加适量水溶解→加热得到热饱和溶液→____→过滤→洗涤→干燥→KNO3。
【答案】NaCl 31.6 不饱和 ![]() ×100% 增加溶质(或蒸发溶剂) < b 降温结晶
×100% 增加溶质(或蒸发溶剂) < b 降温结晶
【解析】
①通过分析溶解度曲线可知,0℃时溶解度较大的物质是氯化钠,20℃时硝酸钾的溶解度是31.6g/100g水,50℃,硝酸钾的溶解度是85.5g,③中的溶质是50g,所以该溶液是不饱和溶液,其溶质的质量分数为![]() ×100%;
×100%;
②硝酸钾的溶解度随温度的升高而增大,所以50℃时,将接近饱和的硝酸钾溶液变为饱和溶液的方法是:增加溶质(或蒸发溶剂);
③50℃时,氯化钠的溶解度小于硝酸钾的溶解度,所以饱和NaCl溶液中溶质的质量分数(w1)与饱和KNO3溶液中溶质的质量分数(w2)的大小关系是:w1<w2;
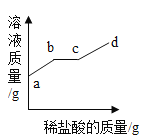
④a、20℃时,KNO3的溶解度为 31.6g,此时100g水中溶解20g硝酸钾形成不饱和溶液①,继续加入30g的硝酸钾后形成饱和溶液②并剩余固体18.4g,故a错误;
b、②→③的过程中溶液温度升高,硝酸钾的溶解度由31.6g→85.5g,则②剩余的18.4g固体全部溶解,溶液溶质质量分数变大,故b正确;
c、溶液④温度为50℃,溶剂量100g,硝酸钾固体质量80g,溶解度是85.5g,所以溶液④是不饱和溶液,溶液⑤温度为20℃,溶剂量100g,溶解度是31.6g,所以溶液④是饱和溶液,④→⑤的过程中析出KNO3晶体80g-31.6g=48.4g,故c错误;
故选:b;
⑤硝酸钾的溶解度受温度变化影响较大,氯化钠的溶解度受温度变化影响较小,所以除去KNO3固体中混有的少量NaCl的实验操作为:加适量水溶解→加热得到热饱和溶液→降温结晶→过滤→洗涤→干燥→KNO3。
故答案为:①NaCl,31.6,不饱和,![]() ×100%;
×100%;
②增加溶质(或蒸发溶剂);
③<;
④b;
⑤降温结晶。

【题目】碘化钾(KI)是白色固体,保存不当会被氧化为单质碘(![]() )而泛黄变质。实验小组为探究碘化钾变质原理,进行如下活动。
)而泛黄变质。实验小组为探究碘化钾变质原理,进行如下活动。
(查阅资料)I.对于碘化钾变质的原理,有两种不同的反应:
甲:![]() ; 乙:
; 乙:![]() 。
。
Ⅱ.![]() 与
与![]() 都属于碱,二者的化学性质相似。
都属于碱,二者的化学性质相似。
(进行实验)实验1:探充变质的原理
取适量碘化钾固体暴露于空气一段时间,观察到固体泛黄。往泛黄的固体中加入足量稀硫酸,产生无色无味的气体,通入澄清石灰水中,澄清石灰水变浑浊。
(1)化学小组认为:据此现象,还不能得出“反应甲是造成碘化钾变质的原因”的结论。理由是____
(进行实验)实验2:探究变质的条件
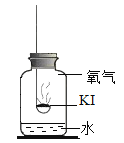
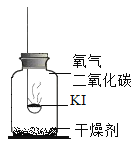
分别取适量KI于燃烧匙中,再分别放入盛有不同物质的集气瓶中,塞紧胶塞,若干天后观察。
实验1 | 实验2 | 实验3 | 实验4 |
|
|
|
|
固体变潮,表面变微黄 | 固体无明显现象 | 固体变潮,无其他明显现象 | 固体变潮,表面变黄 |
(解释与结论)
(2)从上述实验可推知,KI变质的条件是________。
(提出问题)CO2的作用是什么?
(进行实验)
分别取10mL同浓度的KI溶液于3支试管中(试管编号1,2,3),再向试管2中通入CO2,向试管3中滴加几滴盐酸,分别用pH试纸测定溶液的pH;几分钟后,观察溶液的颜色。实验现象记录如下:
td style="width:113.7pt; border-style:solid; border-width:0.75pt; padding:3.38pt 5.03pt; vertical-align:middle">pH=8
试管序号 | 1 | 2 | 3 |
溶液pH | pH=6 | pH=4 | |
溶液颜色 | 无色 | 浅黄色 | 黄色 |
(解释与结论)(3)①pH试纸的使用方法是_______
②CO2在KI变质过程中的作用是________。
(反思与评价)
(4)探究KI变质条件时,同学们排除了氮气和稀有气体的影响,其原因是_______
【题目】实验与探究是化学学习的重要方法和内容,李明看到家里多年未用的铜制火锅上有绿色的锈迹,他对绿色锈迹的成分和性质产生了浓厚兴趣。
【查阅资料】
①绿色锈迹是碱式碳酸铜[Cu2(OH)2CO3],受热易分解;
②无水硫酸铜为白色粉末,遇水变蓝;
③碱石灰是CaO和NaOH的固体混合物,NaOH与CO2反应生成碳酸钠固体和水;
④氧化铜与稀硫酸反应生成蓝色溶液,碳粉不与稀硫酸反应也不溶解在稀硫酸中。
【发现问题】
查阅资料后,该同学将少量碱式碳酸铜放入试管中加热,发现试管中的固体由绿色变成黑色,同时试管壁上有无色液滴生成。
为了进一步确定碱式碳酸铜受热分解的产物,进行了如下探究:
探究一:碱式碳酸铜受热分解生成的黑色固体成分。
【猜想与假设】该黑色固体可能是①碳粉;② ;③碳和氧化铜的混合物。
【设计方案】请帮助该同学完成下述实验报告:
实验操作与现象 | 实验结论 |
猜想②正确 |
探究二:碱式碳酸铜受热分解还会生成CO2和H2O.
【进行实验】选择如下图所示装置进行验证:
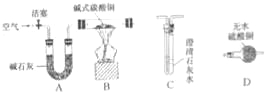
步骤一:连接A和B,打开活塞,通入一段时间的空气;
步骤二:点燃酒精灯,依次连接装置A→B→ → (填“C”,“D”);
步骤三:点燃酒精灯,观察到明显现象后,停止加热。
【解释与结论】
①当观察到 ,说明碱式碳酸铜受热分解生成了CO2和H2O,写出装置C中反应的化学方程式 ;
②写出Cu2(OH)2CO3受热分解的化学方程式 。
【反思与评价】
上述装置中A的作用是 。
【题目】反应物的质量比不同可能会影响生成物的种类,为探究碳还原氧化铜生成的气体种类,设计了下列实验(所有反应均充分进行,浓硫酸用以吸收水蒸汽):
(提出问题):碳还原氧化铜生成的气体是什么?
(作出猜想):猜想①:CO 猜想②:CO2 猜想③:CO2和CO
(实验设计):装置图如图
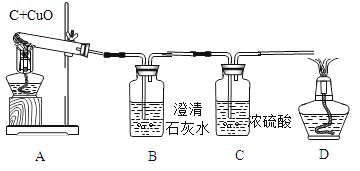
方案一:从定性观察角度判断:
①实验时,A中出现_________________的现象。
②若猜想①成立,B、D处的实验现象是:
B________________,D_________________。
方案二:从定量计算角度判断:
测定表格中的四个数据:
反应前的质量 | 反应后的质量 | |
A(试管+固体) | m1 | m2 |
B+C(广口瓶+溶液) | m3 | m4 |
③若猜想②成立,则(m4-m3)_____(m1-m2)(选填“>”、“<”、“=”)。此时A中发生反应的化学方程式为_____________________________。
④若猜想③成立,且8gCuO全部参与反应,则碳的物质的量(n)的取值范围是____<n<_____。