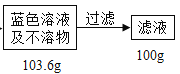
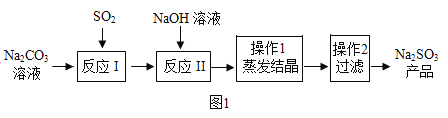
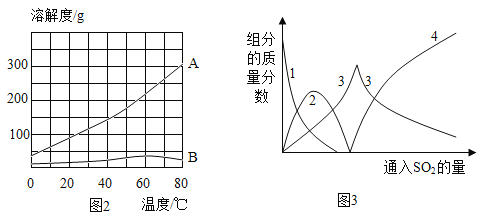
题目内容
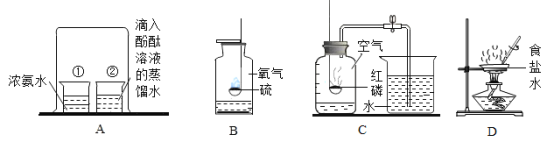
【题目】做电解水实验时,先在水中加入少量含酚酞的硫酸钠溶液(硫酸钠溶液呈中性)再通直流电一段时间,产生的现象如图所示。则下列说法正确的是( )
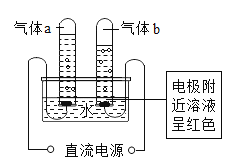
A. 用燃着的木条检验气体a,木条上火焰熄灭
B. 在此反应中硫酸钠的作用是产生氢氧根离子
C. 反应结束后硫酸钠溶液的溶质质量分数不变
D. 与负极相连的电极附近溶液中存在大量氢氧根离子
【答案】D
【解析】
根据电解水时正极产生的是氧气;加入硫酸钠溶液可以增加水的导电性;水分解产生氢气和氧气后水的质量变小;水通电负极得电子,氢氧根带负电来进行分析判断。
A、气体a为氧气,用燃着的木条检验气体a,木条上燃烧的更旺,说法错误;故不符合题意;
B、硫酸钠溶于水电离出钠离子和硫酸根离子,可增强溶液的导电性,在此反应中硫酸钠的作用是增加水的导电性,说法错误;故不符合题意;
C、电解过程中不断的消耗水,水是硫酸钠溶于的溶剂,反应结束后硫酸钠溶液的溶质质量分数变大,说法错误;故不符合题意;
D、负极产生氢气,水分子失去一个氢离子之后形成氢氧根,故与负极相连的电极附近溶液中存在大量氢氧根离子,说法正确;故符合题意;
故选D

 A加金题 系列答案
A加金题 系列答案 全优测试卷系列答案
全优测试卷系列答案【题目】已知某反应的微观示意图如下所示,下列说法错误的是( )
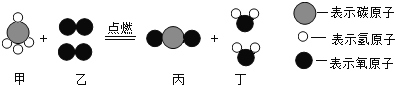
A.反应前后各元素的化合价均不变B.反应前后原子的种类和个数不变
C.参加反应的甲和乙的质量比为1:4D.该反应涉及的物质中有两种属于氧化物
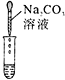
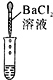
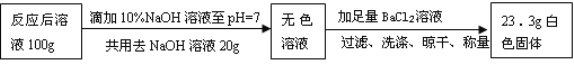
【题目】某白色固体由硫酸钡、碳酸钙、碳酸钠、氢氧化钙中的三种物质组成。为确定其成分,某同学设计并完成如下实验。请把表格中的内容补充完整。
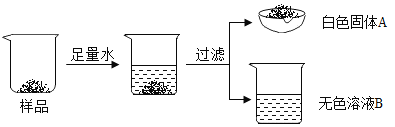
实验操作 | 实验现象 | 结论或解释 | |
① | 取少量白色固体A于试管中,滴加足量稀盐酸 | 有气泡产生 固体有剩余 | 原白色固体中含有__(用化学式表示) |
② | 取少量无色溶液B于试管中,滴加足量稀盐酸 | 有气泡产生 | 原白色固体中含有碳酸钠,生成气体的化学方程式为___ |
③ | 取少量无色溶液B于试管中,先滴加酚酞试液,再加入____ | _ | 原白色固体中含有碳酸钙 |