题目内容
【题目】如图是实验室常用的部分实验装置,请按要求回答问题。
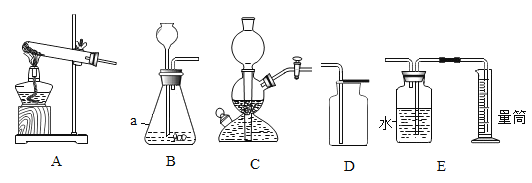
①图中仪器a的名称是________。
②实验室用氯酸钾和二氧化锰混合制取O2,反应的化学方程式为_________;其中二氧化锰固体的颜色是_______。
③实验室用大理石和稀盐酸制取一瓶CO2,发生装置选择_____(填“A”或“B”);用D装置收集二氧化碳,检验集满的方法是____________。
④实验室用稀硫酸和锌粒反应制取氢气,可选择C作为发生装置,理由是_________;E装置可用来测量生成氢气的体积,进行操作时,集气瓶未装满水是否会影响实验结果______(填“是”或“否”)。
⑤计算制取0.5 mol氢气至少需要多少克锌粒与稀硫酸反应?_______。(根据化学方程式列式计算)
【答案】锥形瓶 2KClO3![]() 2KCl+3O2↑ 黑色 B 用燃着的木条放在集气瓶口,火焰熄灭则满 块状(或大颗粒状)固体和液体,不需加热的反应 否 32.5g
2KCl+3O2↑ 黑色 B 用燃着的木条放在集气瓶口,火焰熄灭则满 块状(或大颗粒状)固体和液体,不需加热的反应 否 32.5g
【解析】
①图中仪器a的名称是锥形瓶;
②实验室用氯酸钾和二氧化锰混合制取O2,反应原理是氯酸钾在二氧化锰的作用下受热分解,生成氯化钾和氧气,化学方程式为2KClO3![]() 2KCl+3O2↑;其中二氧化锰固体的颜色是黑色;
2KCl+3O2↑;其中二氧化锰固体的颜色是黑色;
③实验室用大理石和稀盐酸制取一瓶CO2,反应物是固体和液体,条件是常温,发生装置选择B;用D装置收集二氧化碳,检验集满的方法是用燃着的木条放在集气瓶口,火焰熄灭则满;
④实验室用稀硫酸和锌粒反应制取氢气,可选择C作为发生装置,理由是块状(或大颗粒状)固体和液体,不需加热的反应;E装置可用来测量生成氢气的体积,进行操作时,集气瓶未装满水不会影响实验结果,因压入量筒内水的体积等于实验中进入集气瓶内气体的体积;
⑤设制取0.5 mol氢气至少需要物质的量为x的锌粒与稀硫酸反应,
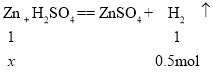
![]()
x = 0.5 mol
Zn的质量为:0.5mol×65g/mol=32.5g