��Ŀ����
����Ŀ��ʵ����ϣ���ʦ֪��ij��ȤС����д����ᴿ��ʵ�飬���������������������ʵ�鱨�档
��ʵ�����ƣ����ε��ᴿ
���������ϣ�
��1�������к�����ɳ������������MgCl2��CaCl2��Na2SO4�����ʡ�
��2��Ba��OH��2��һ��������ˮ��ǿ�
����Ҫ������������Ͳ���ձ���©��������������ͷ�ιܡ��ƾ���
����Ҫ�Լ���������Ʒ��ϡ���ᡢBaCl2��Һ��NaOH��Һ��Na2CO3��Һ������ˮ
��ʵ����̣�
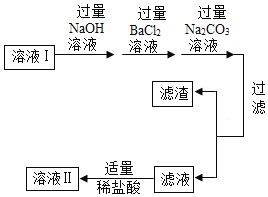
���輰Ŀ�� | ���̼�˵�� |
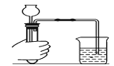
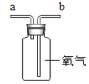
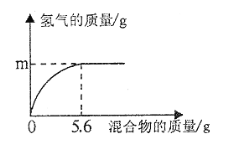
һ��ȥ������ �е���ɳ | 1����ȡ������Ʒ10.0g��������ˮ����ܽ� 2������ȥ����ɳ����ҺI �������������о���Ҫʹ�õ��������������������÷ֱ��ǣ��ܽ�ʱ��____�� ����ʱ��____�� |
����ȥ������ ������ | ����ҺI����ͼ����ͼ���д�����
1������������NaOH��Һʱ����������Ӧ�Ļ�ѧ����ʽ��____�� 2�����˺����õ������ɷ���____�֡� 3���ж���ϡ�����������ķ�����____�� |
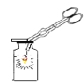
������ò�Ʒ | ����Һ��ע��____�����������ƣ��У������ᾧ���۲쵽____��ֹͣ���ȣ������������ɡ�װ����ȫ��ȴ��ø���IJ�Ʒ9.4g�� |
�ġ����ݴ��� | �ô�����Ʒ���Ȼ��Ƶ�����������94% |
������뷴˼��
��1��ʵ��������Լ���װ�þ����������⣬��ʦȴָ������Ʒ���Ȼ��Ƶ�������������94%��ԭ����____��
��2��С�����������������ֻ������������NaOH��Һ���롰������BaCl2��Һ���ļ���˳�Գ��ӽ��Ҳ�������Ӱ�죬��____���ͬ�⡱��ͬ�⡱��С���Ĺ۵㡣
���𰸡������ܽ� ���� 2NaOH+MgCl2=Mg��OH��2��+2NaC1 4 ������μ������պò��ٲ������� ������ �д���������������������Һ��ʣ�ࣩ �ᴿ�����з�Ӧ�������Ȼ��� ͬ��
��������
[ʵ�����]
һ���������������о���Ҫʹ�õ��������������������÷ֱ��ǣ��ܽ�ʱ���ӿ��ܽ����ʣ�����ʱ��������
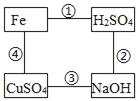
����1������������NaOH��Һʱ�����������ƺ��Ȼ�þ��Ӧ����������þ�������Ȼ��ƣ�������Ӧ�Ļ�ѧ����ʽ�ǣ�2NaOH+MgCl2=Mg��OH��2��+2NaC1��
2�����˺����õ������ɷ���4�֣����������ƺ��Ȼ�þ���ɵ�������þ���Ȼ��������ᷴӦ���ɵ����ᱵ��̼���ƺ��Ȼ������ɵ�̼��ơ�̼���ƺ������Ȼ������ɵ�̼�ᱵ��
3����Һ�е��������Ȼ��ơ��������ơ�̼���ƣ���������ʱ�����������������Ʒ�Ӧ������̼���Ʒ�Ӧ���ɶ�����̼���������ݣ��ж���ϡ�����������ķ����ǣ�������μ������պò��ٲ������ݣ�
�����������ᾧʱ������Һ��ע���������У������ᾧ���۲쵽�д���������������������Һ��ʣ�ࣩʱ��ֹͣ���ȣ������������ɡ�װ����ȫ��ȴ��ø���IJ�Ʒ9.4g��
[����뷴˼]
1.ʵ��������Լ���װ�þ����������⣬��ʦȴָ������Ʒ���Ȼ��Ƶ�������������94%��ԭ�����ᴿ�����з�Ӧ�������Ȼ��ƣ�
2.����������ֻ������������NaOH��Һ������������BaCl2��Һ���ļ���˳�Գ��ӽ��Ҳ�������Ӱ�죬ͬ��С���Ĺ۵㣬������ΪֻҪ̼������Һ�ļ���˳�����Ȼ�����Һ֮��Ͳ�Ӱ��ʵ������