题目内容
【题目】如图所示,“﹣”表示相连物质之间能发生化学反应,请回答下列问题。
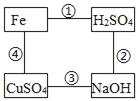
(1)反应③的现象是_____。
(2)反应①的基本反应类型是_____。
(3)H2SO4可以直接转化为CuSO4,写出转化的化学方程式:_____(写一个即可)
(4)反应④可证明Fe的活动性比Cu强,选用下列各组试剂进行实验时,不能验证此结论的是_____(填字母)
A Cu、FeCl2溶液 B Fe、Cu、稀盐酸 C Fe、Cu、ZnSO4溶液 D Fe、CuCl2溶液
【答案】生成蓝色沉淀 置换反应 CuO+H2SO4=CuSO4+H2O C
【解析】
铁和硫酸反应生成硫酸亚铁和氢气,硫酸和氢氧化钠反应生成硫酸钠和水,氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,铁和硫酸铜反应生成硫酸亚铁和铜。
(1)反应③是氢氧化钠和硫酸铜反应生成氢氧化铜沉淀和硫酸钠,故现象是生成蓝色沉淀。
(2)反应①是铁和硫酸反应生成硫酸亚铁和氢气,基本反应类型是置换反应。
(3)H2SO4可以直接转化为CuSO4,氧化铜和硫酸反应生成硫酸铜和水,反应的化学方程式为![]() 。
。
(4)A、Cu和FeCl2溶液不反应,证明Fe的活动性比Cu强,故A正确;
B、Fe和稀盐酸反应,Cu不和稀盐酸反应,证明Fe的活动性比Cu强,故B正确;
C、Fe、Cu和ZnSO4溶液均不反应,无法证明Fe的活动性比Cu强,故C不正确;
D、Fe和CuCl2溶液反应生成铜和氯化亚铁,证明Fe的活动性比Cu强,故D正确。故选C。

 智趣暑假温故知新系列答案
智趣暑假温故知新系列答案 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案【题目】研究物质的溶解对于生产、生活有着重要意义。
①下表是硝酸钾的部分溶解度数据。
温度(℃) | 20 | 40 | 60 | 80 |
溶解度(g/100g水) | 31.6 | 63.9 | 110 | 169 |
由表中数据可知,硝酸钾的溶解度随温度升高而______ (选填“变大”或“变小”)。60℃时硝酸钾饱和溶液中,溶质与溶剂的质量比为_______,能将该饱和溶液转化为不饱和溶液的一种方法是________ 。
②探究20℃时配制硝酸钾溶液过程中,溶质质量分数与加入水的质量关系。向硝酸钾中分批加水,充分搅拌,现象如下图所示:
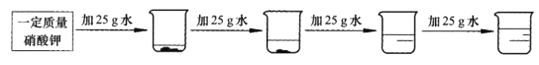
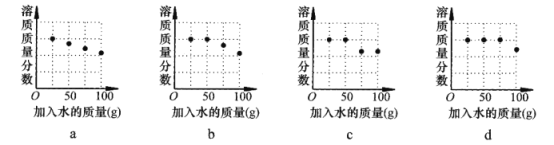
坐标图中,符合实验结果的描点可能是___________(选填编号)。
③取等质量甲和乙两种物质(均不含结晶水)进行如下图所示实验,最终烧杯中析出固体的质量乙大于甲。
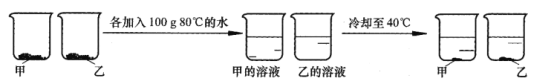
40℃时,甲的溶解度 ______(选填“大于”“等于”或“小于”)乙的溶解度根据本实验结果,能否判断40~80℃间甲、乙哪种物质的溶解度变化随温度影响更大_____ (选填“能”或“不能”)。
【题目】实验课上,老师知道某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
(实验名称)粗盐的提纯
(查阅资料)
(1)粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
(2)Ba(OH)2是一种易溶于水的强碱。
(主要玻璃仪器)量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
(主要试剂)粗盐样品、稀盐酸、BaCl2溶液,NaOH溶液,Na2CO3溶液,蒸馏水
(实验过程)
步骤及目的 | 过程及说明 |
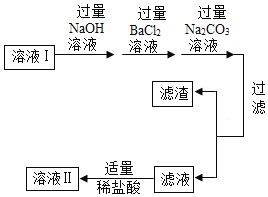
一、去除粗盐 中的泥沙 | 1.称取粗盐样品10.0g,用蒸馏水充分溶解 2.过滤去除泥沙的溶液I 以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时:____; 过滤时:____。 |
二、去除可溶 性杂质 | 将溶液I按如图流程图进行处理:
1、加入“过量NaOH溶液时”,发生反应的化学方程式是____。 2、过滤后,所得的滤渣成分有____种。 3、判断“稀盐酸适量”的方法是____。 |
三、获得产品 | 将溶液Ⅱ注入____(填仪器名称)中,蒸发结晶,观察到____,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。 |
四、数据处理 | 该粗盐样品中氯化钠的质量分数是94% |
(结果与反思)
(1)实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是____。
(2)小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你____(填“同意”或“不同意”)小明的观点。
【题目】请根据不同的实验内容回答对应的问题。
实验内容 | 回答问题 |
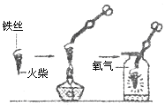
(1)探究氧气的性质 | ①铁丝表面有铁锈,影响了反应的进行,我们应该___________________________。 ②点燃火柴后不能立即伸入瓶内,因为____ ③该反应的化学方程式 __________。 |
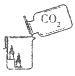
(2)探究二氧化碳的性质 | ①该实验过程中,可观察到的现象是____。 ②从实验现象得出,二氧化碳具有的性质是__。这一性质在实际生活中的应用为____。 |
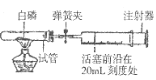
(3)测定空气的成分(试管容40mL,白磷过量且白磷所占体积与导管内的气体体积忽略不计) | ①实验前,打开弹簧夹,将注射器活塞前沿从20mL刻度处推至15mL刻度处,然后松开手,若活塞仍能返回至20mL刻度处,则说明:_____; ②若先夹紧弹簧夹,用酒精灯加热白磷,燃烧结束,等到试管冷却后再松开弹簧夹。可观察到的现象为___________________。 ③若不使用弹簧夹,用酒精灯加热白磷,充分反应直至燃烧结束,试管冷却。可观察到的现象______________________________________________________ |