题目内容
【题目】我国科学家在水煤气变换中引入了高效催化体系,使该反应可在120℃时进行,反应过程如图所示。下列说法错误的是( )
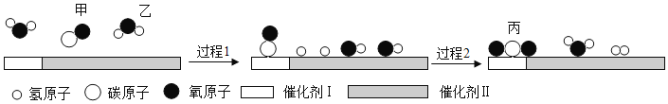
A. 反应前后分子的总数不变
B. 反应每消耗28g甲,可生成44g丙
C. 该过程体现了催化剂吸附微粒的选择性
D. 反应过程中,每消耗1个甲分子,同时消耗1个乙分子
【答案】C
【解析】
由反应的微观模型图可知,在高效催化体系使水煤气中的CO和H2O在120℃下发生反应,反应方程式为: CO+ H2O  CO2 + H2;
CO2 + H2;
A、由化学方程式可知,每2个分子变成了2个分子,反应前后分子的总数不变,故正确;
B、由方程式可知,甲与丙的质量比是28:44,所以反应每消耗28g甲,可生成44g丙,故正确;
C、由微粒的变化可知,该过程不能体现了催化剂吸附微粒的选择性,故错误;
D、由方程式可知,反应过程中,每消耗1个甲分子,同时消耗1个乙分子,故正确。
故选:C。

 快乐小博士巩固与提高系列答案
快乐小博士巩固与提高系列答案【题目】某学习小组的同学对过氧化氢分解进行探究。
Ⅰ、(探究一)影响过氧化氢分解快慢的因素
分别取5mL过氧化氢溶液进行实验,测定产生4mL氧气所需时间,实验结果记录如下:
实验序号 | 过氧化氢溶液的浓度% | 温度℃ | 二氧化锰粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1_____t2(填“>”、 “=”或“<”)
(2)能说明过氧化氢分解快慢与过氧化氢溶液的浓度有关的实验是_______(填实验序号),合理的结论是____________。
交流探讨:二氧化锰属于金属氧化物,其它金属氧化物能否起到类似二氧化锰的催化作用?
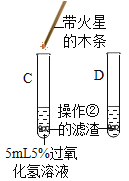
Ⅱ、(探究二)探究氧化铁是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | 氧化铁_______(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、称量。 | 固体质量为________ | 氧化铁质量不变 |
③ |
| C试管上方带火星的木条________, D中溶液变成黄色 | 氧化铁可作过氧化氢分解的催化剂 |
得出结论:过氧化氢分解快慢受______________________________等因素影响。
【题目】实验课上,老师知道某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
(实验名称)粗盐的提纯
(查阅资料)
(1)粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
(2)Ba(OH)2是一种易溶于水的强碱。
(主要玻璃仪器)量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
(主要试剂)粗盐样品、稀盐酸、BaCl2溶液,NaOH溶液,Na2CO3溶液,蒸馏水
(实验过程)
步骤及目的 | 过程及说明 |
一、去除粗盐 中的泥沙 | 1.称取粗盐样品10.0g,用蒸馏水充分溶解 2.过滤去除泥沙的溶液I 以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时:____; 过滤时:____。 |
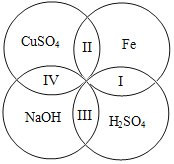
二、去除可溶 性杂质 | 将溶液I按如图流程图进行处理:
1、加入“过量NaOH溶液时”,发生反应的化学方程式是____。 2、过滤后,所得的滤渣成分有____种。 3、判断“稀盐酸适量”的方法是____。 |
三、获得产品 | 将溶液Ⅱ注入____(填仪器名称)中,蒸发结晶,观察到____,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。 |
四、数据处理 | 该粗盐样品中氯化钠的质量分数是94% |
(结果与反思)
(1)实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是____。
(2)小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你____(填“同意”或“不同意”)小明的观点。