题目内容
【题目】下列是制取氧气装置气密性的检查、验满、性质、收集的装置,其中正确的是
A.  检查气密性B.
检查气密性B.  验满
验满
C.  铁丝在氧气中燃烧D.
铁丝在氧气中燃烧D. 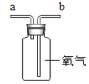 从b进气收集氧气
从b进气收集氧气
【答案】D
【解析】
A、检查有长颈漏斗的气体发生装置的气密性,塞紧橡皮塞,导管上加止水夹并关闭,从长颈漏斗上口注入水,使水浸过长颈漏斗下端,继续加水使长颈漏斗中水面高于试管中水面静置一段时间,若液面高度差不变,则装置不漏气,故A不正确;
B、氧气验满:用带火星的木条接近瓶口,木条复燃说明已满,故B不正确;
C、铁丝在氧气中燃烧生成四氧化三铁,瓶底要放少量水或细沙,防止生成的固体物质溅落下来,炸裂瓶底,故C不正确;
D、氧气的密度比空气大,则氧气要长端进,空气从短管排出,从b进气收集氧气,故D正确。故选D。

 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案【题目】氧气、氮气是我们认识的气体。
(1)下列属于氧气用途的是______________(填字母序号)。

(2)下列变化属于缓慢氧化的是_________(填字母序号)。
A. 天然气燃烧 B. 食物腐烂 C. 液氧气化 D. 动物呼吸
(3)食品包装中充氮气以防腐, 因为氮气_______________________。
(4)利用物质沸点不同可以实现混合物的分离,根据下表数据判断。
物质 | N2 | O2 |
沸点/℃ | -195.8 | -183.0 |
工业上制取氧气,控制温度在_________范围时,可以将液态空气中的氮气与氧气分离开。
【题目】下表是元素周期表的部分信息,请根据下表回答有关问题:
3 Li 锂 6.941 | 4 Be 铍 9.012 | 5 B 硼 10.81 | 6 C 碳 12.01 | 7 N 氮 14.01 | 8 O 氧 16.00 | 9 F 氟 19.00 | 10 Ne 氖 20.18 |
11 Na 钠 22.99 | 12 Mg 镁 24.31 | 13 Al 铝 26.98 | 14 Si 硅 28.09 | 15 P 磷 30.97 | 16 S 硫 32.06 | 17 Cl 氯 35.45 | 18 Ar 氩 39.95 |
(1)铝元素的相对原子质量为____________;
(2)表中与锂元素化学性质相似的元素是__________;
(3)由第7号元素和第12号元素的原子形成化合物的化学式为__________;
(4)某离子带1个单位正电荷,其结构示意图如图所示:![]() ,该离子的符号是____________,该元素位于第_____周期;
,该离子的符号是____________,该元素位于第_____周期;
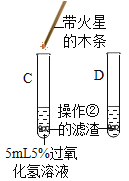
【题目】某学习小组的同学对过氧化氢分解进行探究。
Ⅰ、(探究一)影响过氧化氢分解快慢的因素
分别取5mL过氧化氢溶液进行实验,测定产生4mL氧气所需时间,实验结果记录如下:
实验序号 | 过氧化氢溶液的浓度% | 温度℃ | 二氧化锰粉末用量/g | 反应时间 |
① | 30 | 35 | 0 | t1 |
② | 30 | 55 | 0 | t2 |
③ | 5 | 20 | 0.1 | 3s |
④ | 15 | 20 | 0.1 | 1s |
(1)对比①②可知,其他条件相同时,温度越高,过氧化氢分解越快,则t1_____t2(填“>”、 “=”或“<”)
(2)能说明过氧化氢分解快慢与过氧化氢溶液的浓度有关的实验是_______(填实验序号),合理的结论是____________。
交流探讨:二氧化锰属于金属氧化物,其它金属氧化物能否起到类似二氧化锰的催化作用?
Ⅱ、(探究二)探究氧化铁是否对过氧化氢分解起催化作用
操作步骤 | 实验情况记录 | 结论 | |
① |
| A试管上方带火星的木条未复燃 B中出现气泡快,带火星的木条复燃 | 氧化铁_______(填“不影响”、“减慢”或“加快”)过氧化氢分解 |
② | 将B试管中的混合物过滤,把滤渣烘干、称量。 | 固体质量为________ | 氧化铁质量不变 |
③ |
| C试管上方带火星的木条________, D中溶液变成黄色 | 氧化铁可作过氧化氢分解的催化剂 |
得出结论:过氧化氢分解快慢受______________________________等因素影响。
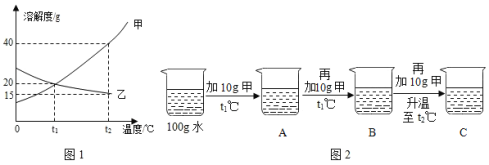
【题目】研究物质的溶解对于生产、生活有着重要意义。
①下表是硝酸钾的部分溶解度数据。
温度(℃) | 20 | 40 | 60 | 80 |
溶解度(g/100g水) | 31.6 | 63.9 | 110 | 169 |
由表中数据可知,硝酸钾的溶解度随温度升高而______ (选填“变大”或“变小”)。60℃时硝酸钾饱和溶液中,溶质与溶剂的质量比为_______,能将该饱和溶液转化为不饱和溶液的一种方法是________ 。
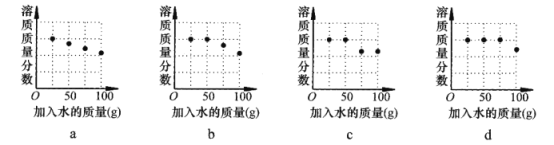
②探究20℃时配制硝酸钾溶液过程中,溶质质量分数与加入水的质量关系。向硝酸钾中分批加水,充分搅拌,现象如下图所示:
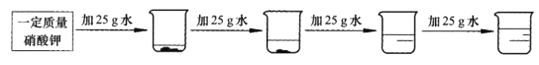
坐标图中,符合实验结果的描点可能是___________(选填编号)。
③取等质量甲和乙两种物质(均不含结晶水)进行如下图所示实验,最终烧杯中析出固体的质量乙大于甲。
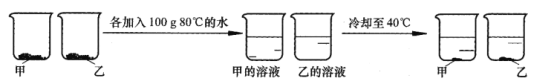
40℃时,甲的溶解度 ______(选填“大于”“等于”或“小于”)乙的溶解度根据本实验结果,能否判断40~80℃间甲、乙哪种物质的溶解度变化随温度影响更大_____ (选填“能”或“不能”)。
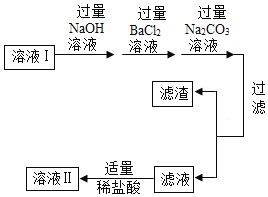
【题目】实验课上,老师知道某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
(实验名称)粗盐的提纯
(查阅资料)
(1)粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
(2)Ba(OH)2是一种易溶于水的强碱。
(主要玻璃仪器)量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
(主要试剂)粗盐样品、稀盐酸、BaCl2溶液,NaOH溶液,Na2CO3溶液,蒸馏水
(实验过程)
步骤及目的 | 过程及说明 |
一、去除粗盐 中的泥沙 | 1.称取粗盐样品10.0g,用蒸馏水充分溶解 2.过滤去除泥沙的溶液I 以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时:____; 过滤时:____。 |
二、去除可溶 性杂质 | 将溶液I按如图流程图进行处理:
1、加入“过量NaOH溶液时”,发生反应的化学方程式是____。 2、过滤后,所得的滤渣成分有____种。 3、判断“稀盐酸适量”的方法是____。 |
三、获得产品 | 将溶液Ⅱ注入____(填仪器名称)中,蒸发结晶,观察到____,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。 |
四、数据处理 | 该粗盐样品中氯化钠的质量分数是94% |
(结果与反思)
(1)实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是____。
(2)小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你____(填“同意”或“不同意”)小明的观点。