题目内容
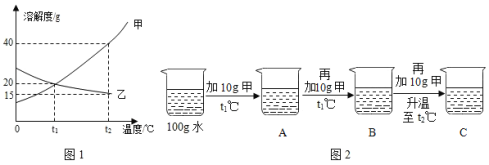
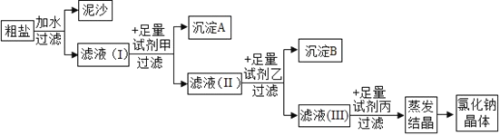
【题目】现在两种金属单质组成的混合物,向100g某种稀盐酸中逐渐加入该混合物,混合物的质量与生成氢气的质量关系如图所示,下列说法正确的是
A. 若混合物为Mg、Al,则m可能是0.2g
B. 若混合物为Zn、Fe,则m一定大于0.2g
C. 若混合物为Fe、Al,则稀盐酸中溶质质量分数可能为15%
D. 若混合物为Zn、Cu,m为0.1g,则该混合物中Zn的质量 分数可能是50%
【答案】C
【解析】
A.若混合物为镁与铝,根据相关的化学方程式,产生0.2g的氢气,需要镁的质量为2.4g,需要铝的质量为1.8g,两者混合产生0.2g氢气时所以需要的质量应在1.8g到2.4g之间,故选项错误;
B.若混合物是锌与铁,根据相关的化学方程式,产生0.2g的氢气,需要锌的质量为6.5g,需要铁的质量为5.6g,若混合物的质量为5.6g,则产生的氢气的质量应小于0.2g,故选项错误;
C.若混合物为铁与铝的混合物,根据相关化学方程式,产生0.2g的氢气,需铁的质量为5.6g,需铝的质量为1.8g,若混合物的质量为5.6g,则产生的氢气的质量应大于0.2g,小于0.62g,根据元素守恒可知,稀盐酸的浓度在7.3%-21.9%之间,所以可能为15%,故选项正确;
D.若混合物是锌与铜,因为铜不与酸反应,所以产生0.1g氢气时,需要的锌为3.25g,则混合物中锌的质量分数为3.25g/5.6g×100%=58.0%,故选项错误。故选C。

 阅读快车系列答案
阅读快车系列答案【题目】实验课上,老师知道某兴趣小组进行粗盐提纯的实验,邀请你帮助他们完成下面的实验报告。
(实验名称)粗盐的提纯
(查阅资料)
(1)粗盐中含有泥沙及少量可溶性MgCl2、CaCl2、Na2SO4等杂质。
(2)Ba(OH)2是一种易溶于水的强碱。
(主要玻璃仪器)量筒、烧杯、漏斗、玻璃棒、胶头滴管、酒精灯
(主要试剂)粗盐样品、稀盐酸、BaCl2溶液,NaOH溶液,Na2CO3溶液,蒸馏水
(实验过程)
步骤及目的 | 过程及说明 |
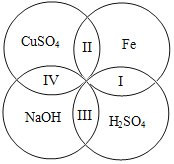
一、去除粗盐 中的泥沙 | 1.称取粗盐样品10.0g,用蒸馏水充分溶解 2.过滤去除泥沙的溶液I 以上两步操作中均需要使用到玻璃棒,玻璃棒的作用分别是:溶解时:____; 过滤时:____。 |
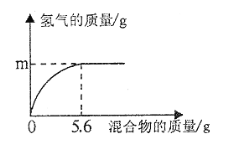
二、去除可溶 性杂质 | 将溶液I按如图流程图进行处理:
1、加入“过量NaOH溶液时”,发生反应的化学方程式是____。 2、过滤后,所得的滤渣成分有____种。 3、判断“稀盐酸适量”的方法是____。 |
三、获得产品 | 将溶液Ⅱ注入____(填仪器名称)中,蒸发结晶,观察到____,停止加热,利用余热蒸干。装置完全冷却后,获得干燥的产品9.4g。 |
四、数据处理 | 该粗盐样品中氯化钠的质量分数是94% |
(结果与反思)
(1)实验操作、试剂和装置均不存在问题,老师却指出该样品中氯化钠的质量分数不是94%,原因是____。
(2)小明提出,如果步骤二中只调换“过量的NaOH溶液”与“过量的BaCl2溶液”的加入顺序,对除杂结果也不会产生影响,你____(填“同意”或“不同意”)小明的观点。