题目内容
【题目】化学兴趣小组在老师的指导下,对测定空气中氧气的体积分数进行了进一步的实验探究。
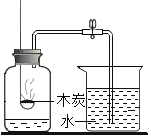
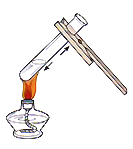
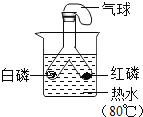
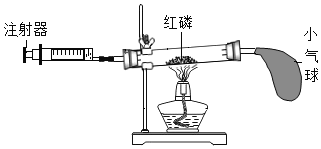
(实验回顾)图1是实验室用燃磷法测定空气中氧气的体积分数的实验装置。
(1)红磷燃烧冒出浓厚的_____,有关的化学方程式是_____。
(2)磷燃烧消耗氧气,并且生成固体,使得集气瓶内的_____减小,于是烧杯中的水倒吸入集气瓶里,以弥补_____的体积,从而粗略测出空气中氧气的体积分数。
(3)燃烧结束后,当集气瓶_____时才能松开止水夹读数。
(问题提出)研究表明,磷燃烧过程中,当氧气的体积分数低于5.9%时燃烧就无法继续进行,因此通过图1装置测得的结果与理论值相差较大。
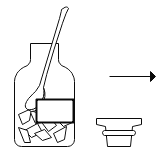
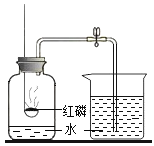
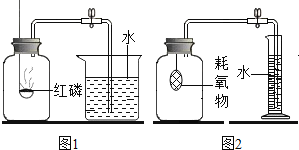
(实验改进)根据铁生锈的原理,同学们设计出如图2所示的装置,再次测定空气中氧气的体积分数。主要的实验步骤与过程如下:
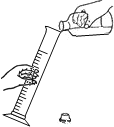
(1)用水量法测出集气瓶的容积约是320 mL,然后在量筒里装入100 mL水。
(2)将4 g铁粉、5 g炭粉混合均匀,再滴入适量的食盐溶液,制成耗氧物,装入布袋。
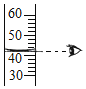
(3)按图2连好装置充分反应后,冷却到室温,打开止水夹可观察到_____;最终量筒中剩余水的体积是39 mL,从而测出空气中氧气的体积分数约是_____(计算结果请精确到0.1%)。
(师生交流)实验结束后,同学们又交流探讨了如下问题。
(1)在耗氧过程中,食盐的作用是_____。
(2)铁在空气中生锈的过程比较复杂,首先是铁与氧气、水反应生成Fe(OH)2(此生成物的名称是_____),该反应的化学方程式为_____。
(3)下列是同学们对于用图2装置进行实验发表的观点,其中不正确的是_____(填字母)。
A 若考虑集气瓶里耗氧物等的体积、导管里空气的体积,实验结果会更准确
B 若将耗氧物均匀撒布在集气瓶内壁上,可以加快实验进程
C 若证明实验后的耗氧物中还有铁,只能用磁铁吸引
D 在实验过程中,耗氧物会缓慢放出热量
【答案】白烟 4P+5O2![]() 2P2O5 压强 氧气 冷却到室温 水被吸入导管 19.1% 加快反应速率 氢氧化亚铁 2Fe+O2+2H2O=2Fe(OH)2 C
2P2O5 压强 氧气 冷却到室温 水被吸入导管 19.1% 加快反应速率 氢氧化亚铁 2Fe+O2+2H2O=2Fe(OH)2 C
【解析】
实验回顾:
(1)红磷燃烧产生大量的白烟,生成五氧化二磷固体,化学方程式4P+5O2![]() 2P2O5;
2P2O5;
(2)磷燃烧消耗氧气,并且生成固体,使得集气瓶内的压强减小,于是烧杯中的水倒吸到集气瓶里,以弥补氧气的体积从而粗略测出空气中氧气的体积分数;
(3)需要等到冷却至室温才能打开止水夹;
实验改进:
(3)耗氧物消耗氧气,导致集气瓶内的压强变小,故打开止水夹会发现水被吸入导管,最终量筒中剩余水的体积是39mL,说明消耗的氧气的体积是:100mL-39mL=61mL,故氧气的体积分数为![]() ×100%≈19.1%。
×100%≈19.1%。
师生交流:
(1)在耗氧过程中,食盐加速铁的锈蚀,从而加速反应;
(2)Fe(OH)2是氢氧化亚铁,铁、氧气和水反应生成氢氧化亚铁,化学反应式为2Fe+O2+2H2O=2Fe(OH)2;
(3)A、若考虑集气瓶里耗氧物等的体积,导管里空气的体积,实验结果会更准确,不符合题意;
B、若将耗氧物均匀散布在集气瓶内壁上,可以增大反应物接触面积,可以加快实验进程,不符合题意;
C、若证明实验后的耗氧物中还有铁,不一定只用磁铁吸引,还可以加酸观察是否产生气体,符合题意;
D、在实验过程中,耗氧物会缓慢放出热量,不符合题意。故选C。

 期末集结号系列答案
期末集结号系列答案【题目】某学习小组拟在实验室里利用空气和镁粉为原料制取少量氮化镁(Mg3N2)。查阅资料可知 Mg、Mg3N2能发生如下反应:
①![]() ②
②![]() ③
③![]() ④
④![]() ⑤
⑤![]()
实验中所用的装置和药品如图所示(镁粉、还原铁粉均已干燥,装置内所发生的反应是完全的,整套装置的末端与干燥管相连)。回答下列问题:
(1)连接并检查实验装置的气密性,实验开始时,将空气通入实验装置,则气流流经装置的顺序是_____(填装置序号)。D装置中发生反应的化学方程式为_____。
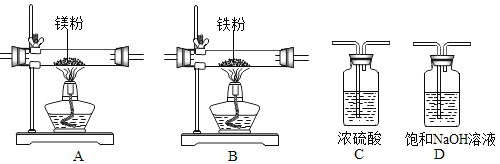
(2)通气后,应先点燃_____(填“A”或“B”)装置的酒精灯,如果同时点燃A、B装置的酒精灯,对实验结果有何影响?_____。
(3)设计一个实验,验证产物是氮化镁:
实验操作和实验现象 | 实验结论 |
_____ | 产物是氮化镁 |
(4)思维拓展:空气中N2的含量远大于O2的含量,而镁条在空气中燃烧生成的MgO的质量却远大于Mg3N2的质量,请给出合理的解释_____。
【题目】取一定量氯化镁溶液于烧杯中,将100g的氢氧化钠溶液平均分成五次加入烧杯中。在化学反应过程中对烧杯中的溶液和沉淀进行了多次过滤并称量。加入的氢氧化钠溶液和生成沉淀的质量关系记录如下表。
实验次数 | 第1次 | 第2次 | 第3次 | 第4次 | 第5次 |
加入的氢氧化钠溶液质量/g | 20 | 20 | 20 | 20 | 20 |
沉淀总质量/g | 2.9 | 5.8 | 8.7 | 11.6 | 11.6 |
分析上表中的数据,完成下列问题:
(1)第_____次加完氢氧化钠溶液时,氯化镁和氢氧化钠恰好完全反应,此时生成沉淀质量为_____g。
(2)恰好完全反应时,称量所得氯化钠溶液质量为168.4g,则原氯化镁溶液中溶质的质量分数是____(请写出计算过程)。