题目内容
【题目】下列实验装置或实验操作正确的是( )
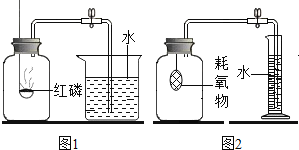
A.  测定空气中氧气含量B.
测定空气中氧气含量B. 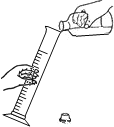
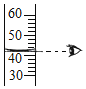 向量筒内倾倒液体并读数
向量筒内倾倒液体并读数
C. 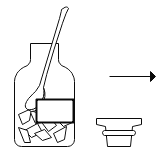
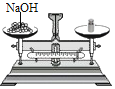 称取氢氧化钠D.
称取氢氧化钠D. 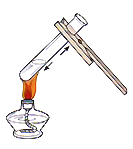 加热液体
加热液体
【答案】D
【解析】
A、木炭在氧气生成二氧化碳气体,虽除去氧气,但增加了新的气体,不能用于测定空气中氧气含量,图中所示操作错误;
B、与向试管内倾倒液体相似,①试剂瓶瓶口紧挨量筒,防止液体流出;②标签向着手心,防止液体流出腐蚀标签;③瓶塞倒放桌面上,防止污染瓶塞,从而污染药品,图中标签没有向着手心,图中所示操作错误;
C、氢氧化钠具有很强的腐蚀性,应放在玻璃器皿中称量,且瓶塞没有倒放,图中所示操作错误;
D、给试管中的液体加热时,用酒精灯的外焰加热试管里的液体,且液体体积不能超过试管容积的1/3,图中所示操作正确。
故选:D。

 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案【题目】某校实验室有一瓶久置的铁屑,其成分是铁、氧化铁和水。为测定其中各成分的质量分数,某兴趣小组按下图所示装置进行实验(装置气密性良好;固定装置已略去;氮气不与铁屑中的成分反应;碱石灰是氧化钙和氢氧化钠的混合物)。
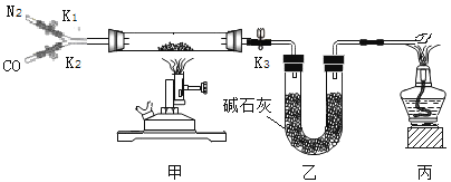
部分实验步骤如下:
Ⅰ.称量硬质玻璃管的质量。将样品放入硬质玻璃管中,称量硬质玻璃管和样品的质量。
II.连接好装置。缓缓通入N2,点燃甲处的酒精喷灯,待硬质玻璃管中固体恒重,记录硬质玻璃管和剩余固体的质量。
Ⅲ.再次连接好装置,继续实验。通入CO,点燃丙处的酒精灯和甲处的酒精喷灯。待硬质玻璃管中固体恒重,熄灭酒精喷灯,继续通入CO直至硬质玻璃管冷却。再次记录硬质玻璃管和剩余固体的质量。
实验数据记录如下表:
硬质玻璃管 | 硬质玻璃管和样品 | 步骤II硬质玻璃 管和剩余固体 | 步骤步骤Ⅲ硬质玻璃 管和剩余固体 | |
质量 | m1 | m2 | m3 | m4 |
请回答下列问题:
(1)步骤Ⅲ丙处酒精灯的作用是____________。
(2)步骤Ⅲ硬质玻璃管中反应的化学方程式为________。
(3)样品中氧化铁的质量分数为_____(用m1、m2、m3、m4的代数式表示)。若步骤Ⅲ中氧化铁没有完全反应,样品中水的质量分数测量结果将______(填“偏大”“偏小”或“不变”)。
(4)有关样品,下列说法正确的是_____(填字母标号)。
A样品中氢元素的质量为1/9(m2-m3) B样品中铁单质和氧化铁的质量总和为m3-m1
C样品中铁单质的质量为m4-m1 D样品中氧元素的质量为m3-m4
【题目】小明同学对家中久置的袋装固体食品防腐剂的成分产生了兴趣(品名和成分如图所示),于是和同学一起,设计实验进行探究:

[提出问题]久置固体食品防腐剂的成分是什么?
[查阅资料]铁与氯化铁溶液在常温下发生反应生成氯化亚铁。
[作出猜想]久置固体中可能含有Fe、Fe2O3、CaO、Ca(OH)2和CaCO3 。
[实验探究]甲同学的探究方案如下表:
实验操作 | 实验现象 | 实验结论 |
(1)取少量固体放于试管中,加足量蒸馏水溶解,静置后取上层清液滴加无色酚酞溶液 | 固体溶解时试管外壁发烫,试管底部有不溶物,溶液变红。 | 固体中一定含有_____和氢氧化钙。此过程的化学方程式_____。 |
(2)另取少量固体放于试管中,滴加足量的稀盐酸 | 固体逐渐消失,有大量无色气体产生,得到浅绿色溶液。 | 固体中一定含有Fe,一定不含 Fe2O3 |
(3)将步骤(2)中产生的气体通入到澄清的石灰水中 | _____。 | 固体中一定含有CaCO3 |
[交流与反思]
(1)“504双吸剂”中的铁粉可以吸收空气中的_____、_____。
(2)实验操作(2)的实验现象里“有大量无色气体产生”,根据甲同学的整体探究方案推测,无色气体的成分应当是_____、_____。
(3)小明同学认为久置固体食品防腐剂中是否含Fe还可以用_____检验。
(4)乙同学认为甲同学的实验中不能得出一定含Ca(OH)2的结论,理由是_____。
(5)丙同学认为甲同学的实验并不能得出一定不含Fe2O3的结论,理由是_____。
【题目】某校化学研究性学习小组探究气体制取的实验原理与方法.
(1)甲同学将课本的基础知识进行整理如图,请你帮助他完成相关内容.

制取气体 | 所需要品 | 装置连接顺序 | 反应的化学方程式 |
二氧化碳(干燥) | 大理石和稀盐酸 | ______________ | ______________________________ |
(2)乙同学设计的实验装置(如图),既可用于制取气体,又可用于验证物质性质.当打开K1、关闭K2时,利用I、Ⅱ装置可直接进行的实验是______________(填序号).

①大理石与稀盐酸反应制取二氧化碳
②锌与稀硫酸反应制取氢气
(3)丙同学认为在不改变I、Ⅱ、Ⅲ装置的仪器及
位置的前提下,该装置可用于过氧化钠(Na2O2)与水反应制取氧气,另一产物为氢氧化钠,则该反应的化学方程式为:______________________________;她的改进措施是_______________________________________________________.
(4)丁同学打开K2、关闭K1,利用I、Ⅲ装置来验证生成的二氧化碳中含有水蒸气,此时C中盛放的物质是_______________,可以观察到的现象是________________________________________.
(5)对用氯酸钾和二氧化锰的混合物制取O2后的固体残渣(假定已完全反应)作如下回收处理:
①通过以下四步实验操作回收二氧化锰.正确操作的先后顺序是____________(填写选项序号).
a.烘干b.溶解c.过滤d.洗涤
②用所得氯化钾晶体配制50g质量分数为5%的氯化钾溶液,需要氯化钾的质量为_______g.
③过滤、蒸发时都需用到的仪器是__________(填序号).
A.酒精灯B.烧杯C.玻璃棒D.漏斗E.量筒
(6)小明用6.5g可能含有铜、铝、铁、镁中的一种或几种金属杂质的锌粉,跟足量的稀盐酸完全反应时,生成0.2g氢气,则此锌粉中一定含有的金属杂质是________________.