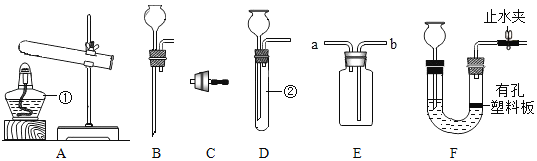
��Ŀ����
����Ŀ��ȡһ�����Ȼ�þ��Һ���ձ��У���100g������������Һƽ���ֳ���μ����ձ��С��ڻ�ѧ��Ӧ�����ж��ձ��е���Һ�ͳ��������˶�ι��˲����������������������Һ�����ɳ�����������ϵ��¼���±���
ʵ����� | ��1�� | ��2�� | ��3�� | ��4�� | ��5�� |
���������������Һ����/g | 20 | 20 | 20 | 20 | 20 |
����������/g | 2.9 | 5.8 | 8.7 | 11.6 | 11.6 |
�����ϱ��е����ݣ�����������⣺
��1����_____�μ�������������Һʱ���Ȼ�þ����������ǡ����ȫ��Ӧ����ʱ���ɳ�������Ϊ_____g��
��2��ǡ����ȫ��Ӧʱ�����������Ȼ�����Һ����Ϊ168.4g����ԭ�Ȼ�þ��Һ�����ʵ�����������____����д��������̣���
���𰸡�4 11.6 19%
��������
�⣺����ǰ�Ĵζ���ÿ������2.9g�ij�����������γ����������ӣ����Ե��Ĵ���ȫ��Ӧ����ʱ���ɳ���������Ϊ 11.6g��
��ԭ�Ȼ�þ��Һ�����ʵ���������Ϊx�����Ȼ�þ��Һ������Ϊ168.4g+11.6g��80g��100g
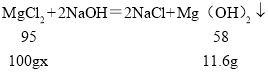
![]()
x��19%��

 �������ϵ�д�
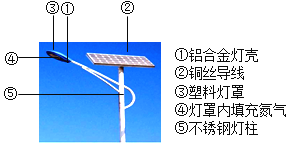
�������ϵ�д�����Ŀ������Դ�Ŀ������������������ɳ�����չ����Ҫ���⡣�⡢��ȼ�ϵ����һ��������Դ�����õ������ӿ����л�õķ�����______�������е�������������㣬��Լ�ǿ����������![]() ������������Ȼ����ȡ�����ַ�����ȡ���������������ж�����̼��һ����̼��Ϊ��֤�����������H2��CO2��CO�������嶼���ڣ�һ��ѧʵ��С���������ʵ�顣
������������Ȼ����ȡ�����ַ�����ȡ���������������ж�����̼��һ����̼��Ϊ��֤�����������H2��CO2��CO�������嶼���ڣ�һ��ѧʵ��С���������ʵ�顣
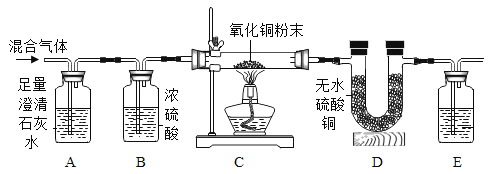
���Ķ���ʾ��
��ʵ��ǰ��װ���ڵĿ������ž���
��ʵ������е�β���Ѵ�����
����ˮ����ͭ�ǰ�ɫ��ĩ����ˮ�������
��ش��������⡣
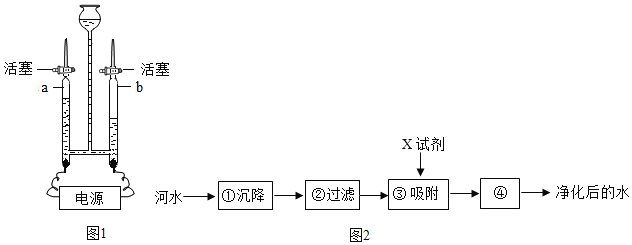
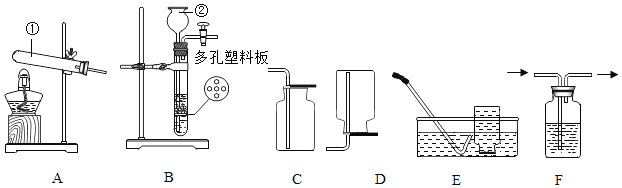
��1��Aװ�õ�������______��
��2��Cװ���е�ʵ��������______��
��3��Eװ����ʢ�ŵ��Լ�Ӧ����______����װ���з�����Ӧ�Ļ�ѧ����ʽΪ______��
��4��֤���������ڵ�ʵ��������______��
��5����һС��ͬѧ��������ʵ��װ�ã������е�Eװ�û���װ�м�ʯ�ҵĸ���ܣ�����������ʵ����̣�ͨ�������ķ���ȷ��һ����̼���ڣ���¼ʵ���������£�
��ע����Ӧ���ɵ�ˮ������Dװ����ȫ���գ�����������ˮ������ʵ������Ӱ�죩
ʵ��ǰCװ�ò������ڹ���������/g | m1 |
ʵ���Cװ�ò������ڹ���������/g | m2 |
ʵ��ǰDװ��������/g | n1 |
ʵ���Dװ��������/g | n2 |
����������ݣ��������֤��CO���ڵ�������ϵ��______������m1��m2��n1��n2��ʾ��
����Ŀ����1��ˮ�����������������ء�
��Ӳˮ��������������������鷳��һ�����_____������Ӳˮ����ˮ��
�������û���̿����ˮ�е���ζ��ɫ�أ�����̿������������_____�����������ѧ�������ʡ�
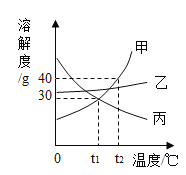
��2���±���KNO3��Ca��OH��2�ڲ�ͬ�¶�ʱ���ܽ�ȡ��ش��й����⣺
�¶�/�� | 10 | 20 | 30 | 40 | 50 | 60 | |
�ܽ��/g | KNO3 | 20.9 | 31.6 | 45.8 | 63.9 | 85.5 | 110.0 |
Ca��OH��2 | 0.19 | 0.17 | 0.16 | 0.14 | 0.13 | 0.11 | |
�����������У��ܽ�����¶����߶���С����_____��
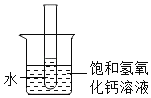
��60��ʱ����ͼʾ������
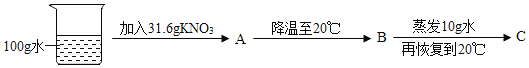
A�е���Һ��_____������͡������͡�����Һ��
C�����������������_____g��
����ͼ�����ձ��м���һ����������粒��壬��ʱ�Թ�������������Һ����������������_____�������䡱��С������