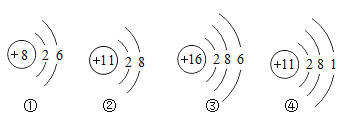
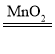��Ŀ����
����Ŀ���ϳɰ���ҵ�У�����̼�����Һ���ղ�����CO2�õ�̼����أ���Ӧ�Ļ�ѧ����ʽΪ��K2CO3+CO2+H2O=2KHCO3������̼�����Һ��ͨ��CO2��ǡ����ȫ��Ӧ���õ����ʵ���������Ϊ10%����Һ50g���Լ��㣺
��1���Ѹ�50g��Һϡ��Ϊ��������Ϊ5%����Һ����Ҫ����ˮ������Ϊ_____��
��2���μӷ�Ӧ�Ķ�����̼������Ϊ_____��
��3��ԭ̼�����Һ�����ʵ���������_____��д��������̣������ȷ��0.1%����
���𰸡�50g 1.1g 7.1%
��������
��1�����Ѹ�50g10%����Һ��ϡ��Ϊ���ʵ���������Ϊ5%����Һ������ϡ��ǰ�����ʵ������������䣬������ˮ������Ϊx��
50g��10%=��50g+x����5%
��ã�x=50g
�𣺼����ˮ������Ϊ50g��
��2������뷴Ӧ��̼��ص�����Ϊy��������̼������Ϊz��
���ʵ���������Ϊ10%����Һ50g��̼����ص�����Ϊ10%��50g=5g

![]()
��ã�y=3.45g��z=1.1g
�𣺲��뷴Ӧ�Ķ�����̼������Ϊ1.1g��
��3��ԭ̼�����Һ�����ʵ���������Ϊ��![]() ��100%��7.1%
��100%��7.1%
��ԭ̼�����Һ�����ʵ���������ԼΪ7.1%��

 ��һ������ĩ�ٷֳ�̾�ϵ�д�
��һ������ĩ�ٷֳ�̾�ϵ�д�����Ŀ��ijУ��ѧ�о���ѧϰС��̽��������ȡ��ʵ��ԭ���뷽����
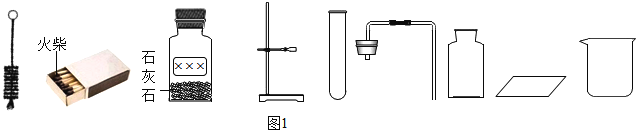
��1����ͬѧ���α��Ļ���֪ʶ����������ͼ��������������������ݣ�

��ȡ���� | ����ҪƷ | װ������˳�� | ��Ӧ�Ļ�ѧ����ʽ |
������̼����� | ����ʯ��ϡ���� | ______________ | ______________________________ |
��2����ͬѧ��Ƶ�ʵ��װ�ã���ͼ�����ȿ�������ȡ���壬�ֿ�������֤�������ʣ�����K1���ر�K2ʱ������I����װ�ÿ�ֱ�ӽ��е�ʵ����______________������ţ���

�ٴ���ʯ��ϡ���ᷴӦ��ȡ������̼
��п��ϡ���ᷴӦ��ȡ����
��3����ͬѧ��Ϊ�ڲ��ı�I����װ�õ�������
λ�õ�ǰ���£���װ�ÿ����ڹ������ƣ�Na2O2����ˮ��Ӧ��ȡ��������һ����Ϊ�������ƣ���÷�Ӧ�Ļ�ѧ����ʽΪ��______________________________�����ĸĽ���ʩ��_______________________________________________________��
��4����ͬѧ��K2���ر�K1������I����װ������֤���ɵĶ�����̼�к���ˮ��������ʱC��ʢ�ŵ�������_______________�����Թ۲쵽��������________________________________________��
��5����������غͶ������̵Ļ������ȡO2��Ĺ���������ٶ�����ȫ��Ӧ�������»��մ�����
��ͨ�������IJ�ʵ��������ն������̣���ȷ�������Ⱥ�˳����____________����дѡ����ţ���
a�����b���ܽ�c������d��ϴ��
���������Ȼ��ؾ�������50g��������Ϊ5%���Ȼ�����Һ����Ҫ�Ȼ��ص�����Ϊ_______g��
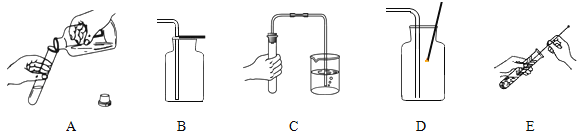
�۹��ˡ�����ʱ�����õ���������__________������ţ���
A���ƾ���B���ձ�C��������D��©��E����Ͳ
��6��С����6.5g���ܺ���ͭ����������þ�е�һ�ֻ��ֽ������ʵ�п�ۣ���������ϡ������ȫ��Ӧʱ������0.2g���������п����һ�����еĽ���������________________��