题目内容
有一矿山上的石灰石样品中只含杂质二氧化硅(二氧化硅是一种既不溶于水,也不与盐酸反应的固体)。小琳和她的同学想测定该样品中碳酸钙的质量分数。他们取一块石灰石样品,将其粉碎后,称出9.4g放入烧杯内(烧杯的质量为60.8g),然后慢慢加入稀盐酸,用玻璃棒搅拌至不再产生气泡为止,共用去稀盐酸97.8g。再称出反应后烧杯及其内物质的总质量为164.7g。试回答:
(1)将石灰石样品粉碎的主要目的是 。
(2)实验结束后,共放出二氧化碳 g(假设溶解在水中的二氧化碳质量忽略不计)。
(3)该石灰石样品中碳酸钙的质量分数是多少?(计算结果精确到0.1%)
(4)反应后溶液的质量为 g。
(1)为了增大反应物的接触面积,使反应能快速进行
(2)3.3g
(3)79.8%
(4)102
解析试题分析:(1)为避免样品中碳酸钙不能完成反应,可把样品粉碎,增大样品与盐酸的接触面积,此举还可以加快反应的速率;
(2)根据质量守恒定律可以知道放出气体二氧化碳的质量=9.4g+60.8g+97.8g-164.7g=3.3g
(3)设石灰石样品中碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 2.2g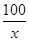 =
= 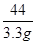
解得:x=7.5g
该石灰石中w(CaCO3)= 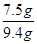 ×100%=79.8%
×100%=79.8%
答:该石灰石样品中碳酸钙的质量分数是79.8%.
(4)反应后溶液的质量为:164.7g-60.8g-(9.4g-7.5g)=102g
考点:根据化学反应方程式的计算

张南同学为测定某赤铁矿样品中氧化铁的含量,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设样品中杂质不与稀硫酸反应,也不溶于水)。每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入稀硫酸的质量/g | l0 | l0 | l0 | l0 | l0 |
| 剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
请认真分析表中的数据,回答下列问题:
(1)表示样品与稀梳酸恰好完全反应的是上表中第 次操作;
(2)写出样品中氧化铁与稀硫酸反应的化学方程式 ;
(3)列出充分反应后求解生成水质量(X)的比例式为 ;
(4)样品中氧化铁的含量为 ;
(5)假设第四次实验结束后,向所得混合物中入ag水,得到溶质质量分数为10%的硫酸铁溶液,则a的数值为 ;
(6)若实验用98%的浓硫酸配制上述所用稀硫酸(50g),需要浓硫酸的质量为 。
碳和碳的氧化物是生活中常见的物质,也是初中化学学习的重要内容.
(1)如图 是,下列说法不正确的是 .
是,下列说法不正确的是 .
| A.氧原子的质子数为8 |
| B.氧原子在化学反应中易失去电子 |
| C.氧是地壳中含量最多的元素 |
| D.氧原子与氧离子的化学性质不同 |
(3)实验室里,几位同学在制取二氧化碳.
①小刚同学用浓度为15%的稀盐酸与块状大理石反应制取二氧化碳,小明同学用浓度为8%的稀盐酸与块状大理石反应制取二氧化碳,发现小刚同学收集到相同体积二氧化碳的速度比小同学快,由此你能得到的结论是 .
②小平同学用加热碳酸氢钠的方法也能制得CO2,已知碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,请写出该反应的化学方程式 .
(4)小明将氢氧化钠溶液与氯化钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀,请你用化学方程式解释可能的原因.(提示:BaCO3是白色、难溶于水)
(5)一氧化碳和氢气虽然具有相似的化学性质,如还原性、可燃性等,但一氧化碳却不是新能源的发展方向,从安全和环保的角度来看,这其中的重要原因是什么?
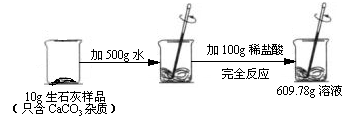
(6)称取5g石灰石(杂质不参加反应)放入烧杯中,向其中加入足量稀盐酸,将反应生成的气体全部通入有足量澄清石灰水的烧杯中(气体全部被吸收),反应结束后称量烧杯中物质的质量增加了1.76g.试计算石灰石中含有杂质的质量分数.
 3X+4H2O为动力来源.
3X+4H2O为动力来源.