题目内容
某石灰厂需要测定产品生石灰中杂质(杂质只含CaCO3)的质量分数。小刚进行了如图实验。请计算:
(1)生成CO2气体的质量;
(2)样品中CaCO3的质量分数。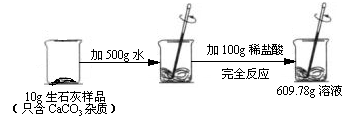
(1)0.22g (2)10%
解析试题分析:根据质量守恒定律:参加化学反应的各物质的质量总和,等于反应后生成的各物质的质量总和,所以根据质量差可直接求出二氧化碳的质量=10g+500g+100g-609.78g=0.22g,再根据化学方程式:CaCO3+2HCl=CaCl2+H2O+CO2↑中CaCO3与CO2的质量关系,便可算出CaCO3的质量,进而可求样品中CaCO3的质量分数
解:设碳酸钙的质量为x
CaCO3+2HCl=CaCl2+H2O+CO2↑
100 44
x 0.22g
100:44=x:0.22g ∴x=1g
故样品中CaCO3的质量分数=1g/10g×100%=10%
考点:根据化学方程式进行计算

练习册系列答案
相关题目
同学们从山上采集到一种石灰石,他们取80克该样品进行煅烧实验(所含杂质在煅烧过程中不发生变化),测得反应后固体的质量(m)与反应时间(t)的关系如下表:
| 反应时间t∕s | t0 | t1 | t2 | t3 | t4 | t5 | t6 |
| 反应后固体的质量m∕g | 80 | 75 | 70 | 66 | 62 | 58 | 58 |
请回答下列问题:
(1)当石灰石完全反应后,生成CO2的质量为 g。
(2)求该石灰石中CaCO3的质量分数,写出计算过程。
小苏打(主要成分为NaHCO3)中常含有少量氯化钠。化学兴趣小组的同学为了测定某品牌小苏打中NaHCO3的质量分数,进行了以下实验:称量样品置于烧杯中,向其中慢慢滴加稀盐酸,至不再产生气泡为止,测得的有关数据如下表所示。
| 物质 | 样品 | 消耗的稀盐酸 | 反应后的溶液 |
| 质量(g) | 9 | 75.4 | 80 |
(1)样品中的NaHCO3的质量分数;
(2)所得溶液中NaCl的质量分数。


 CaO+ CO2↑
CaO+ CO2↑