题目内容
碳和碳的氧化物是生活中常见的物质,也是初中化学学习的重要内容.
(1)如图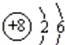 是,下列说法不正确的是 .
是,下列说法不正确的是 .
| A.氧原子的质子数为8 |
| B.氧原子在化学反应中易失去电子 |
| C.氧是地壳中含量最多的元素 |
| D.氧原子与氧离子的化学性质不同 |
(3)实验室里,几位同学在制取二氧化碳.
①小刚同学用浓度为15%的稀盐酸与块状大理石反应制取二氧化碳,小明同学用浓度为8%的稀盐酸与块状大理石反应制取二氧化碳,发现小刚同学收集到相同体积二氧化碳的速度比小同学快,由此你能得到的结论是 .
②小平同学用加热碳酸氢钠的方法也能制得CO2,已知碳酸氢钠受热分解生成碳酸钠、二氧化碳和水,请写出该反应的化学方程式 .
(4)小明将氢氧化钠溶液与氯化钡溶液混合,发现无明显现象.一段时间后,他再次取敞口放置的上述两种溶液进行混合,结果出现了白色沉淀,请你用化学方程式解释可能的原因.(提示:BaCO3是白色、难溶于水)
(5)一氧化碳和氢气虽然具有相似的化学性质,如还原性、可燃性等,但一氧化碳却不是新能源的发展方向,从安全和环保的角度来看,这其中的重要原因是什么?
(6)称取5g石灰石(杂质不参加反应)放入烧杯中,向其中加入足量稀盐酸,将反应生成的气体全部通入有足量澄清石灰水的烧杯中(气体全部被吸收),反应结束后称量烧杯中物质的质量增加了1.76g.试计算石灰石中含有杂质的质量分数.
(1)B;(2)二者的分子结构不同;(3)①其他条件相同时,反应物浓度越大,反应速率越快;
②2NaHCO3 Na2CO3+H2O+CO2↑;(4)CO2+NaOH═Na2CO3+H2O;
Na2CO3+H2O+CO2↑;(4)CO2+NaOH═Na2CO3+H2O;
Na2CO3+BaCl2═BaCO3↓+2NaCl;(5)一氧化碳有毒,燃烧生成二氧化碳,该气体能产生温室效应;
(6)20%.
解析试题分析:(1)根据原子结构示意图的意义可以知道:A.氧原子的质子数为8,故A说法正确;B.根据图示可以知道氧原子的最外层电子数大于4个,所以容易得到电子,故B说法错误;C.氧是地壳中含量最多的元素,故C说法正确;D.元素的化学性质取决于原子的最外层电子数,氧离子是氧原子得到电子之后而形成的,故氧原子与氧离子的化学性质不同,故D说法正确;故选B.(2)一氧化碳和二氧化碳的分子构成不同,所以它们的性质不同;(3)根据题给的条件可以知道,在反应条件相同的情况下,只有盐酸的浓度不同,而实验中观察到15%的稀盐酸与块状大理石反应制取二氧化碳,比用浓度为8%的稀盐酸与块状大理石反应制取二氧化碳的速率快,所以可以知道其他条件相同时,反应物浓度越大,反应速率越快;(4)氢氧化钠溶液可以和二氧化碳反应生成碳酸钠,而碳酸钠能够和氯化钡反应生成生成碳酸钡沉淀,可以据此写出该反应的化学方程式为:;CO2+2NaOH═Na2CO3+H2O;Na2CO3+BaCl2═BaCO3↓+2NaCl; (5)一氧化碳有毒,燃烧生成二氧化碳,该气体能产生温室效应,所以一氧化碳不是新能源的发展方向;
(6)根据题意可以知道烧杯中增加的质量即为生成的二氧化碳的质量为1.76g,
设石灰石中含有的碳酸钙的质量为x
CaCO3+2HCl═CaCl2+H2O+CO2↑
100 44
x 1.76g =
=
解得:x=4g
石灰石中杂质的质量分数为: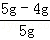 ×100%=20%
×100%=20%
答:石灰石中杂质的质量分数为20%.
考点:一氧化碳的化学性质;二氧化碳的化学性质;碱的化学性质;盐的化学性质;根据化学反应方程式的计算.

⑴一定条件下,下列物质在密闭容器内充分反应,反应前后各物质的质量如下:
| 物质 | A | B | C | D |
| 反应前的质量/g | 1.7 | 2.2 | 7.9 | 0.9 |
| 反应后的质量/g | 待测 | 6.6 | 0 | 2.7 |
则:①反应后A的待测质量为 ; ②该反应所属的基本反应类型是 ;
③反应中B和D两种物质变化的质量比为 (最简整数比)。
⑵人体缺少钙元素会影响健康,因此每日需摄人足够的钙。目前市场上的补钙药剂很多,以下是某品牌补钙药剂说明书的部分信息。请仔细阅读后进行计算:

①葡萄糖酸钙的相对分子质量为____________。
②葡萄糖酸钙中碳、氢、氧、钙四种元素的质量比为 。
③(葡萄糖酸钙中钙元素的质量分数为多少?(保留至0.1%,写计算过程,下同)
④按照说明书的用量,每天可补充多少mg钙元素?(精确到0.1)