题目内容
张南同学为测定某赤铁矿样品中氧化铁的含量,取10g此样品,分五次向其中加入稀硫酸使之充分反应(假设样品中杂质不与稀硫酸反应,也不溶于水)。每次加入的稀硫酸质量及测定剩余固体的质量,记录数据如下表:
| | 第一次 | 第二次 | 第三次 | 第四次 | 第五次 |
| 加入稀硫酸的质量/g | l0 | l0 | l0 | l0 | l0 |
| 剩余固体质量/g | 8.4 | 6.8 | 5.2 | 3.6 | 3.6 |
请认真分析表中的数据,回答下列问题:
(1)表示样品与稀梳酸恰好完全反应的是上表中第 次操作;
(2)写出样品中氧化铁与稀硫酸反应的化学方程式 ;
(3)列出充分反应后求解生成水质量(X)的比例式为 ;
(4)样品中氧化铁的含量为 ;
(5)假设第四次实验结束后,向所得混合物中入ag水,得到溶质质量分数为10%的硫酸铁溶液,则a的数值为 ;
(6)若实验用98%的浓硫酸配制上述所用稀硫酸(50g),需要浓硫酸的质量为 。
(1)四 (2)Fe2O3+3H2SO4=Fe2(SO4)3 +3H2O (3)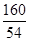 =
=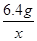 或
或 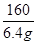 =
=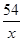
(4)64% (5)113.6g (6)15g
解析试题分析:(1)由表中信息根据记录数据可知每10g稀硫酸可反应掉1.6g锌,第四次时10g稀硫酸正好反应了1.6g氧化铁且第五次固体质量不再减少,所以第四次时样品与稀硫酸恰好完全反应,试样中的氧化铁即充分反应的氧化铁的质量为10g-3.6g=6.4g;
(2)氧化铁与稀硫酸反应生成硫酸铁和水,Fe2O3+3H2SO4=Fe2(SO4)3 +3H2O;
(3)由上述化学方程式,和充分反应的氧化铁的质量为6.4g,可以列出生成水质量(X)的比例式为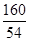 =
=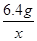 或
或 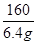 =
=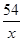
(4)试样中的氧化铁即充分反应的氧化铁的质量为6.4g,10g此样品中氧化铁的含量为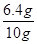 ×100%=64%
×100%=64%
(5)稀释前后溶质质量不变,由化学方程式用氧化铁的质量为6.4g可以求出生成的硫酸铁质量为16g,第四次实验结束后溶液的质量为10g×4+6.4g="46.4" g,所以可以列式得:(46.4 g+6.4g+ag)×10%=16g,解得a=113.6g;
(6)由化学方程式用氧化铁的质量为6.4g求出四次反应的硫酸质量为11.76g,稀硫酸的质量分数为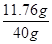 ×100%=29.4%;设需要浓硫酸的质量为x,因为稀释前后溶质质量不变,所以98%x=50g×29.4% 解得x=15g
×100%=29.4%;设需要浓硫酸的质量为x,因为稀释前后溶质质量不变,所以98%x=50g×29.4% 解得x=15g
考点:根据化学反应方程式的计算;有关溶质质量分数的简单计算

练习册系列答案
相关题目
 CaO+ CO2↑
CaO+ CO2↑