��Ŀ����
����Ŀ���ڿ�������״��������ս��������ɱ����������������Ҫ�������Ǽ��ֳ�������������
(һ)�ƾ�(C2H5OH)
(1)������ 75%��ҽ�þƾ���Һʱ���� 75mL �ľƾ��� 25mL ��ˮ��Ϻ����С�� 100mL����ԭ����________��
(2)������ʹ�þƾ�������ʱ��������������ȼ��������ը����ȼ�յ����������������������______���ƾ���ȫȼ�յĻ�ѧ����ʽ��______��
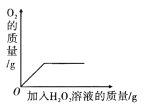
(��)����������Һ ���ǩ�ϵIJ���������ͼ��

(1)�ӱ�ǩ�ϵijɷ���Ϣ������֪������������Һ����ʱ������_____��
(2)һƿ������Һ�к����ʹ�������_____g��
(3)����������̼���⡢��Ԫ�ص�������Ϊ________________(�����������)��
(4)����ʵ����е�Уҽÿ�춼��������������Ϊ0.5%�Ĺ� ��������Һ�Խ��ҵȳ�������������Ҫ����������Һ 600kg����Ҫ������������Ϊ 40%�Ĺ���������Һ____________kg��
(��)��������(ClO2)
���ϣ���ClO2��һ�ֻ���ɫ���д̼�����ζ�����壬�۵㣺��59.0�����е㣺11.0��������ȴ��11.0������ʱ��ɺ�ɫҺ�壬��������ˮ���ܼ����ֽ⣬������Ӧ����ɱ����Ư���������� �� Cl2������ˮ��ʱ�������к����ʣ�Ҳ����������������ʱ�����ij�ζ��
(1)���Ϲ��� ClO2 �������У����ڻ�ѧ���ʵ���________________(�����)��
(2)��ȡ ClO2 �ķ����ж��֣�Ŀǰŷ��һЩ������������(NaClO3)��Ũ���ᷴӦ��ȡ ClO2(Kestiog ��)��ͬʱ�� Cl2��NaCl ��һ�ֳ��������������ɣ��÷�Ӧ���漰����Ԫ�صĻ��ϼ���________�֣�
(3)�ҹ�����о��ɹ��� Cl2 �� NaClO2(N2 ������)��ȡ ClO2��ͬʱ�� NaCl ���ɣ��÷�Ӧ�Ļ�ѧ����ʽ��_____________���˷��� Kestiog ����ȣ����ŵ���_________�� (д�����е�һ��)
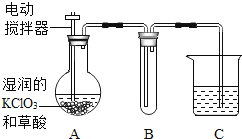
(4)��ҵ��Ҳ������ 60��ʱ�����Լӳ�ʪ�� KClO3 �����(C2H2O4)��Ӧ��ȡ ClO2��ijʵ��С��������ͼװ����ȡ���ռ� ClO2��A Ϊ ClO2 �ķ���װ�ã�B Ϊ ClO2 ���ռ�װ�ã�C Ϊβ������װ�á�
���ʣ�Ϊ�˱�֤ʵ��ɹ���ʵ��ʱ��A װ��Ӧ����_____�м��ȣ� B װ����ӱ�ˮ��ȴ���Թ��ڿɹ۲쵽��������________��C ����ʢ�ŵ�ҩƷ������______��
���𰸡�����֮���п�϶ �þƾ����¶ȴﵽ�Ż�� C2H5OH+3O2![]() 2CO2+3H2O �ֽ� 200 6:1:12 7.5 �ܢ� 4 Cl2+2NaClO2=2ClO2+2NaCl ���������ж����� Cl2(���Ʒ����) 60��ˮԡ ���ֺ�ɫҺ�� ����������Һ(��������Һ)
2CO2+3H2O �ֽ� 200 6:1:12 7.5 �ܢ� 4 Cl2+2NaClO2=2ClO2+2NaCl ���������ж����� Cl2(���Ʒ����) 60��ˮԡ ���ֺ�ɫҺ�� ����������Һ(��������Һ)
��������
��һ��
��1��75mL �ľƾ��� 25mL ��ˮ��Ϻ����С�� 100mL����ԭ���Ƿ���֮���п�϶��һ���־ƾ����ӽ���ˮ���ӵĿ�϶�У����»�Ϻ�����С�ڶ������֮�ͣ�
��2��ȼ�յ���������ȼ���������������Ӵ������¶ȴﵽ�Ż�㡣��ȼ�յ�����������������������þƾ����¶ȴﵽ�Ż�㣬�ƾ���ȫȼ������ˮ�Ͷ�����̼����Ӧ�Ļ�ѧ����ʽ��C2H5OH+3O2![]() 2CO2+3H2O��
2CO2+3H2O��
������
��1������������Һ�д��ڹ������⣬�������������ֽ⡣�ӱ�ǩ�ϵijɷ���Ϣ������֪������������Һ����ʱ�������ֽ⣻
��2��һƿ������Һ�к����ʹ�������Ϊ��500g��40%=200g��
��3������������̼���⡢��Ԫ�ص�������=(12��2):(1��4):(16��3)= 6:1:12��
��4����Ҫ������������Ϊ 40%�Ĺ���������ҺΪx����Һ��ϡ���������ʵ��������䣬���У�600kg��0.5%=40%��x��x=7.5kg��
������
��1����ClO2��һ�ֻ���ɫ���д̼�����ζ�����壬��Щ���ʲ���Ҫͨ����ѧ�仯���ֳ����������������ʣ�
����ȴ��11.0������ʱ��ɺ�ɫҺ�壬����Ҫͨ����ѧ�仯���ֳ����������������ʣ�
��������ˮ������Ҫͨ����ѧ�仯���ֳ����������������ʣ�
�ܼ����ֽ⣬��Ҫͨ����ѧ�仯���ֳ��������ڻ�ѧ���ʣ�
������Ӧ����Ҫͨ����ѧ�仯���ֳ��������ڻ�ѧ����
��ɱ����Ư���������� Cl2���������ʵ���;����ѡ�ܢݣ�
��2����������(NaClO3)��Ũ���ᷴӦ��ȡ ClO2(Kestiog ��)��ͬʱ�� Cl2��NaCl ��һ�ֳ��������������ɣ����������غ㶨�ɺ�������ĸ����֪���÷�Ӧ�з�Ӧ����NaClO3��HCl����������Cl2��NaCl��ClO2��H2O������NaClO3����Ԫ�ػ��ϼ�Ϊ+5�ۣ�HCl����Ԫ�ػ��ϼ�Ϊ-1�ۣ�Cl2����Ԫ�ػ��ϼ�Ϊ0�ۣ�NaCl����Ԫ�ػ��ϼ�Ϊ-1�ۣ�ClO2����Ԫ�ػ��ϼ�Ϊ+4�ۣ��漰����Ԫ�صĻ��ϼ���4�֣�
��3���� Cl2 �� NaClO2(N2 ������)��ȡ ClO2��ͬʱ�� NaCl ���ɣ��÷�Ӧ�Ļ�ѧ����ʽ��Cl2+2NaClO2=2ClO2+2NaCl���˷��� Kestiog ����ȣ����ŵ��Ǵ˷���Kestiog����ȣ����ŵ��Dz��������ж����� Cl2(���Ʒ����)��
��4���������ٹ�ҵ��Ҳ������ 60��ʱ�����Լӳ�ʪ�� KClO3 �����(C2H2O4)��Ӧ��ȡ ClO2����֪��Ϊ�˱�֤ʵ��ɹ���ʵ��ʱ��A װ��Ӧ����60��ˮԡ�м��ȣ� B װ����ӱ�ˮ��ȴ��������ClO2��һ�ֻ���ɫ���д̼�����ζ�����壬�۵㣺��59.0�����е㣺11.0��������ȴ��11.0������ʱ��ɺ�ɫҺ�����Թ��ڿɹ۲쵽�������dz��ֺ�ɫҺ�壻������ClO2����Ӧ����֪��Ϊ�Ϻõط�ֹClO2й©��C���ձ���Ӧʢ�ŵ�Һ����Ũ����������Һ��

 ��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�
��ĩ���100�ִ��½����ȫ�Ծ�ϵ�д�����Ŀ���ס��ҡ����������ʵ�ת����ϵ��ͼ��ʾ����������ʾ��Ӧ����һ��ʵ��(�������ʺͷ�Ӧ������ʡ��)������ѡ���в��ܰ�ͼʾת����ϵʵ�ֵ���
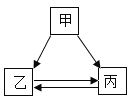
ѡ�� | �� | �� | �� |
A | H2SO4 | H2O | H2 |
B | NaOH | NaCl | NaNO3 |
C | C | CO2 | CO |
D | Ca (OH) 2 | CaCl2 | CaCO3 |
A.AB.BC.CD.D