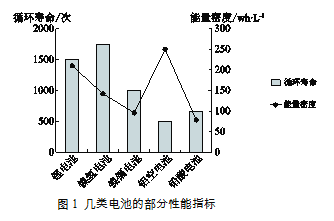
题目内容
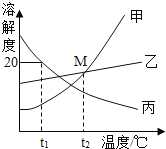
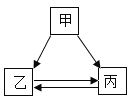
【题目】甲、乙、丙三种物质的转化关系如图所示,“→”表示反应可以一步实现(部分物质和反应条件已省略),下面选项中不能按图示转化关系实现的是
选项 | 甲 | 乙 | 丙 |
A | H2SO4 | H2O | H2 |
B | NaOH | NaCl | NaNO3 |
C | C | CO2 | CO |
D | Ca (OH) 2 | CaCl2 | CaCO3 |
A.AB.BC.CD.D
【答案】B
【解析】
A、硫酸(甲)和活泼金属锌、铁、铝等反应生成氢气(丙),和碳酸盐或者碱等反应生成水(乙),氢气(丙)体现可燃性或者还原性都能生成水(乙),水(乙)也能在通电的条件下生成氢气(丙)和氧气,该转化能实现,正确;
B、氢氧化钠(甲)和盐酸或者某些金属氯化物如入氯化镁、氯化铝、氯化铁等反应生成氯化钠(乙),和硝酸或者某些金属硝酸盐如硝酸镁、硝酸铝、硝酸铁等反应反应生成硝酸钠(丙),氯化钠(乙)可以和硝酸银反应生成硝酸钠(丙),硝酸钠(丙)不能生成氯化钠(乙),该转化不能实现,错误;
C、碳(甲)在氧气不足的情况下燃烧生成一氧化碳(丙),氧气充足的情况下生成二氧化碳(乙),一氧化碳(丙)体现可燃性或者还原性都能生成二氧化碳(乙),二氧化碳(乙)在高温下和碳反应生成一氧化碳(丙),该转化能实现,正确;
D、氢氧化钙(甲)盐酸反应生成氯化钙(乙),和二氧化碳或者可溶性碳酸盐反应生成碳酸钙(丙),氯化钙(乙)和可溶性碳酸盐反应能生成碳酸钙(丙),碳酸钙(丙)和盐酸反应生成氯化钙(乙),该转化能实现,正确。故选B。

 小学夺冠AB卷系列答案
小学夺冠AB卷系列答案 ABC考王全优卷系列答案
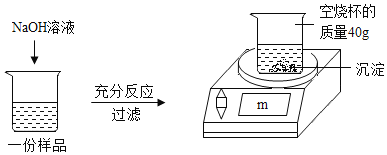
ABC考王全优卷系列答案【题目】为测定某CuSO4溶液中溶质的质量分数,取150g CuSO4溶液,平均分为三份,每份样品均按如图所示进行实验,实验数据见下表。请计算:
实验1 | 实验2 | 实验3 | |
样品质量/g | 50 | 50 | 50 |
NaOH溶液质量/g | 20 | 40 | 60 |
m/g | 42.45 | 44.9 | 44.9 |
(1)50g CuSO4溶液完全反应时,所得沉淀的质星为_____g。
(2)CuSO4溶液中溶质的质量分数为_____。