1、『2008广东高考』镁、铜等金属离子是人体内多种酶的辅因子。工业上从海水中提取镁时,先制备无水氯化镁,然后将其熔融电解,得到金属镁。
(1)以MgCl2为原料用熔融盐电解法制备镁时,常加入NaCl、KCl或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有 。
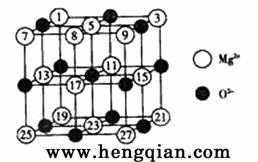
(2)已知MgO的晶体结构属于NaCl型。某同学画出的MgO晶胞结构示意图如右图所示,请改正图中错误: 。
(3)用镁粉、碱金属盐及碱土金属盐等可以做成焰火。燃放时,焰火发出五颜六色的光,请用原子结构的知识解释发光的原因: 。
(4)Mg是第三周期元素,该周期部分元素氟化物的熔点见下表:
|
氧化物 |
NaF |
MgF2 |
SiF4 |
|
熔点/K |
1266 |
1534 |
183 |
解释表中氟化物熔点差异的原因: 。
(5)人工模拟是当前研究的热点。有研究表明,化合物X可用于研究模拟酶,当其结合
 或Cu(I)(I表示化合价为+1)时,分别形成a和b:
或Cu(I)(I表示化合价为+1)时,分别形成a和b:

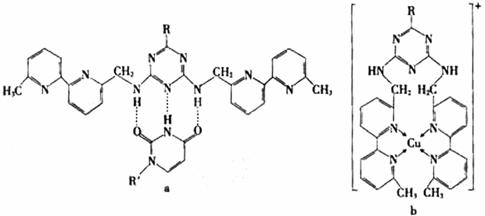
①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有 键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用力的差异
。
答案:(1) 以MgCl2为原料用熔融盐电解法制备Mg时,常加入NaCl、KCl、或CaCl2等金属氯化物,其主要作用除了降低熔点之外还有:增大离子浓度,从而增大熔融盐的导电性。
(2) 请更正图中错误:⑧应为黑色。
(3) 请用原子结构的知识解释发光的原因:原子核外电子按一定轨道顺序排列,轨道离核越远,能量越高。燃烧时,电子获得能量,从内侧轨道跃迁到外侧的另一条轨道。跃迁到新轨道的电子处在一种不稳定的状态,它随即就会跳回原来轨道,并向外界释放能量(光能)。
(4) 解释表中氟化物熔点差异的原因:NaF与MgF2为离子晶体,SiF4为分子晶体,所以NaF与MgF2远比SiF4熔点要高。又因为Mg2+的半径小于Na+的半径,所以MgF2的离子键强度大于NaF的离子键强度,故MaF2的熔点大于NaF。
(5) ①a中连接相邻含N杂环的碳碳键可以旋转,说明该碳碳键具有:σ键的特性。
②微粒间的相互作用包括化学键和分子间相互作用,比较a和b中微粒间相互作用的差异:a中微粒间的相互作用为氢键,b中微粒间的相互作用为配位共价键。
2、非极性键和极性键的比较
|
|
非极性键 |
极性键 |
|
概念 |
同种元素原子形成的共价键 |
不同种元素原子形成的共价键,共用电子对发生偏移 |
|
原子吸引电子能力 |
相同 |
不同 |
|
共用电子对 |
不偏向任何一方 |
偏向吸引电子能力强的原子 |
|
成键原子电性 |
电中性 |
显电性 |
|
形成条件 |
由同种非金属元素组成 |
由不同种非金属元素组成 |
1、离子键、共价键和金属键的比较
|
化学键类型 |
离子键 |
共价键 |
金属键 |
|
概念 |
阴、阳离子间通过静电作用所形成的化学键 |
原子间通过共用电子对所形成的化学键 |
金属阳离子与自由电子通过相互作用而形成的化学键 |
|
成键微粒 |
阴阳离子 |
原子 |
金属阳离子和自由电子 |
|
成键性质 |
静电作用 |
共用电子对 |
电性作用 |
|
形成条件 |
活泼金属与活泼的非金属元素 |
非金属与非金属元素 |
金属内部 |
|
实例 |
NaCl、MgO |
HCl、H2SO4 |
Fe、Mg |
4.了解分子晶体与原子晶体、离子晶体、金属晶体的结构微粒、微粒间作用力的区别.
|
晶体类型 |
原子晶体 |
分子晶体 |
金属晶体 |
离子晶体 |
|
粒子 |
原子 |
分子 |
金属阳离子、自由电子 |
阴、阳离子 |
|
粒子间作用(力) |
共价键 |
分子间作用力 |
复杂的静电作用 |
离子键 |
|
熔沸点 |
很高 |
很低 |
一般较高,少部分低 |
 较高 较高 |
|
硬度 |
很硬 |
一般较软 |
一般较硬,少部分软 |
较硬 |
|
溶解性 |
难溶解 |
相似相溶 |
难溶(Na等与水反应) |
易溶于极性溶剂 |
|
导电情况 |
不导电 (除硅) |
一般不导电 |
良导体 |
固体不导电,熔 化或溶于水后导电 |
|
实例 |
金刚石、水晶、碳化硅等 |
干冰、冰、纯硫酸、H2(S) |
Na、Mg、Al等 |
NaCl、CaCO3 NaOH等 |
例38.下面的排序不正确的是
A.晶体熔点由低到高:CF4<CCl4<CBr4<CI4 B.硬度由大到小:金刚石>碳化硅>晶体硅
C.熔点由高到低:Na>Mg>Al D晶格能由大到小: NaF> NaCl> NaBr>NaI
例39.关于晶体的下列说法正确的是
A.在晶体中只要有阴离子就一定有阳离子 B.在晶体中只要有阳离子就一定有阴离子
C.原子晶体的熔点一定比金属晶体的高 D.分子晶体的熔点一定比金属晶体的低
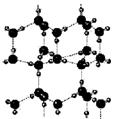 例35.右图为冰晶体的结构模型,大球代表O原子,小球代表H原子.
例35.右图为冰晶体的结构模型,大球代表O原子,小球代表H原子. D.冰晶体熔化时,水分子之间的空隙增大
D.冰晶体熔化时,水分子之间的空隙增大