摘要:离子键.共价键和金属键的比较 化学键类型 离子键 共价键 金属键 概念 阴.阳离子间通过静电作用所形成的化学键 原子间通过共用电子对所形成的化学键 金属阳离子与自由电子通过相互作用而形成的化学键 成键微粒 阴阳离子 原子 金属阳离子和自由电子 成键性质 静电作用 共用电子对 电性作用 形成条件 活泼金属与活泼的非金属元素 非金属与非金属元素 金属内部 实例 NaCl.MgO HCl.H2SO4 Fe.Mg
网址:http://m.1010jiajiao.com/timu_id_4373425[举报]
 氧气是化工生产的重要原料,很多金属和非金属都能和氧气直接作用.
氧气是化工生产的重要原料,很多金属和非金属都能和氧气直接作用.(1)第二周期某种元素形成的氧化物分子中,既含有σ键又含有π键且二者数目相同的物质的结构式为
O=C=O
O=C=O
,其中心原子杂化方式为sp
sp
.氧元素与氟元素能形成OF2分子,该分子的空间构型为V形
V形
.氮元素的电负性<
<
(填“>”、“=”或“<”)氧,主要原因是氧原子半径比氮原子小,吸电子能力较强
氧原子半径比氮原子小,吸电子能力较强
.(2)氧元素和过渡元素可形成多种价态的金属氧化物,如Cr2O3、Fe2O3、V2O5.基态铬原子外围电子排布式为
3d54s1
3d54s1
.核电荷数比Fe大1的元素在元素周期表中的位置为第四
四
周期Ⅷ
Ⅷ
族.(3)四种同主族元素的氧化物晶体的晶格能数据如下表:
| 氧化物 | MgO | CaO | SrO | BaO |
| 晶格能/kJ?mol-1 | 3791 | 3410 | 3223 | 3054 |
MgO
MgO
.根据表中数据,说明影响上表中晶格能大小的主要因素同主族元素的离子所带电荷数相同,离子半径越小,离子键越强,晶格能越大
同主族元素的离子所带电荷数相同,离子半径越小,离子键越强,晶格能越大
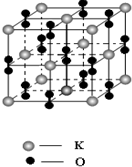
.(4)某种由氧和钾元素形成的化合物,其晶胞结构如右图所示,该晶体的化学式为
KO2
KO2
. (1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.
(1)现有A、B、C、D、E五种元素,A的原子核中没有中子;B、C元素处于同一周期,C的原子半径较小,B、C的质子数之和为27,质子数之差为5;0.96g D的单质跟足量盐酸反应,生成D3+和1.2L(标准状况)氢气;E和C能形成E2C型离子化合物,且E、C两元素的简单离子具有相同电子层结构.①写出元素符号:A
H
H
,CS
S
,EK
K
.②B、D的最高价氧化物对应水化物相互反应的离子方程式为:
Al(OH)3+OH-=AlO2-+2H2O
Al(OH)3+OH-=AlO2-+2H2O
.③用电子式表示C与E形成E2C的过程:


(2)元素在周期表中的位置,反映了元素的原子结构和元素的性质.右图是元素周期表的一部分.
①阴影部分元素N在元素周期表中的位置为第
二
二
周期第ⅤA
ⅤA
族.根据元素周期律,预测:酸性强弱 H3AsO4
<
<
H3PO4.(用“>”或“<”表示)②元素S的最高正价和最低负价的代数和为
+4
+4
,在一定条件下,S与H2反应有一定限度(可理解为反应进行的程度),请判断:在相同条件下Se与H2反应的限度比S与H2反应限度更小
更小
.(选填“更大”、“更小”或“相同”)③Br2具有较强的氧化性,SO2具有较强的还原性,将SO2气体通入溴水后,溶液中存在的主要离子是
Br-、SO42-、H+
Br-、SO42-、H+
.④下列说法正确的是
A、B、D
A、B、D
A.C、N、O、F的原子半径随着原子序数的增大而减小
B.Si、P、S、Cl元素的非金属性随着核电荷数的增加而增强
C.干冰升华、液态水转变为气态都要克服分子内的共价键
D.HF、HCl、HBr、HI的热稳定性依次减弱.
C60(结构模型如图所示)的发现是化学界的大事之一。C60与金属钾化合生成K3C60,K3C60具有超导性。

(1)碳原子的价电子排布式为____________。
(2)C60分子中的杂化轨道介于石墨和金刚石的杂化轨道之间,则石墨和金刚石中碳原子的杂化方式分别
是________、________。
(3)K3C60属于离子晶体,其中阴阳离子个数比为1:3,则该晶体的构成微粒为____。(用化学式表示)
(4)已知C60晶体内相邻C60球体间的距离是304pm,与石墨平面层间距离(335pm)相比较,说明C60晶体中 C60和C60间作用力属于_______(填“离子键”、“共价键”或“分子间作用力”),两者数据存在差异的原因是_____________。
查看习题详情和答案>>
(2)C60分子中的杂化轨道介于石墨和金刚石的杂化轨道之间,则石墨和金刚石中碳原子的杂化方式分别
是________、________。
(3)K3C60属于离子晶体,其中阴阳离子个数比为1:3,则该晶体的构成微粒为____。(用化学式表示)
(4)已知C60晶体内相邻C60球体间的距离是304pm,与石墨平面层间距离(335pm)相比较,说明C60晶体中 C60和C60间作用力属于_______(填“离子键”、“共价键”或“分子间作用力”),两者数据存在差异的原因是_____________。
C60(结构模型如图所示)的发现是化学界的大事之一。C60与金属钾化合生成K3C60,K3C60具有超导性。

(1)碳原子的价电子排布式为____________。
(2)C60分子中的杂化轨道介于石墨和金刚石的杂化轨道之间,则石墨和金刚石中碳原子的杂化方式分别
是________、________。
(3)K3C60属于离子晶体,其中阴阳离子个数比为1:3,则该晶体的构成微粒为____。(用化学式表示)
(4)已知C60晶体内相邻C60球体间的距离是304pm,与石墨平面层间距离(335pm)相比较,说明C60晶体中 C60和C60间作用力属于_______(填“离子键”、“共价键”或“分子间作用力”),两者数据存在差异的原因是_____________。
查看习题详情和答案>>
(2)C60分子中的杂化轨道介于石墨和金刚石的杂化轨道之间,则石墨和金刚石中碳原子的杂化方式分别
是________、________。
(3)K3C60属于离子晶体,其中阴阳离子个数比为1:3,则该晶体的构成微粒为____。(用化学式表示)
(4)已知C60晶体内相邻C60球体间的距离是304pm,与石墨平面层间距离(335pm)相比较,说明C60晶体中 C60和C60间作用力属于_______(填“离子键”、“共价键”或“分子间作用力”),两者数据存在差异的原因是_____________。
X、Y 、Z、W是原子序数依次增大的四种短周期元素。已知X为非金属元素,且X与W同族。Y、Z为同周期的相邻元素,Y的氢化物分子中有3个共价键,Z原子最外层电子数是次外层电子数的3倍。W原子的质子数等于Y、Z原子的最外层电子数之和。请回答:
⑴四种元素的原子半径由大到小的顺序是 (填元素符号)
⑵比较Y和Z的气态氢化物的稳定性: > (填化学式)
⑶元素X和Z形成的化合物X2Z2,在MnO2存在的条件下,实验室用它来制取Z单质,写出反应方程式_____
⑷由X、Y 、Z三种元素所形成的常见共价化合物是 ,离子化合物是 。
⑸W的单质的化学式为 ,其最高价氧化物的水化物中含有的化学键是 。