例4.(09年海南化学·3)除去NaHCO3溶液中混有的少量Na2CO3可采取的方法是:
A.通入二氧化碳气体 B.加入氢氧化钡溶液
C.加入澄清石灰水 D.加入稀盐酸
[解析]除杂方法要操作简便、效果好、不带来新的杂质、保留非杂质成份。溶液中可用这样的方法: Na2CO3 + H2O + CO2 = 2NaHCO3。
[答案]A
例5. 某天然碱(纯净物)可看作由CO2和NaOH反应后的产物所组成。称取天然碱样品四份,溶于水后,分别逐滴加入相同浓度的盐酸溶液30mL,产生CO2的体积(标准状况)如下表:(2000年上海高考题)
|
|
Ⅰ |
Ⅱ |
Ⅲ |
Ⅳ |
|
盐酸液的体积(mL) |
30 |
30 |
30 |
30 |
|
样品(g) |
3.32 |
4.15 |
5.81 |
7.47 |
|
二氧化碳的体积(mL) |
672 |
840 |
896 |
672 |
(1)由第Ⅰ组数据中的CO2体积与样品质量之比,可以推测用2.49 g样品进行同样的实验时,产生CO2_________mL(标准状况)。
(2)另取3.32g天然碱样品于300℃加热分解至完全(300℃时Na2CO3不分解),产生CO2112mL(标准状况)和水0.45g,计算并确定该天然碱的化学式。
(3)已知Na2CO3和HCl(aq)的反应分下列两步进行:
Na2CO3+HCl→NaCl+NaHCO3 Na2CO3+HCl→NaCl+CO2↑+H2O
由上表中第Ⅳ组数据可以确定所用的HCL(aq)的浓度为 mol/L。
(4)依据上表所列数据以及天然碱的化学式,讨论并确定上述实验中CO2(标准状况)体积V(mL)与样品质量W(g)之间的关系式。
[解析]试题以天然碱的组成及碳酸盐的性质为依托,构筑一道有层次、有深度且思维容量较大的计算题。对信息的理解能力、对数据的观察和处理能力是解答本题的关键。
(1)(672 mL/3.32 g)×2.49 g=504 mL。
(2)由题意可知,天然碱含NaHCO3、Na2CO3。
n(NaHCO3)=2n(CO2)=2×(112/22400)mol=0.01mol n(Na2CO3)=(672/22400)mol-0.01mol=0.02mol n(H2O)=[(0.45g-(112/22400)mol×18mol)/18mol=0.02mol
所以天然碱组成为2Na2CO3.NaHCO3.2H2O(式量332)。
(3)7.47 g样品中:n(Na2CO3)=(7.47 g/332 g.mol-1)×2=0.045 mol,则:
Na2CO3完全生成NaHCO3消耗HCl:0.045mol;生成672mLCO2消耗HCl:672mL/22400 mL.mol-1=0.03 mol。故c(HCl)=(0.045 mol+0.03 mol)/0.030 L=0.025 mol/L。
(4)30ml盐酸中n(HCl)=0.075mol,设样品与HCl反应全转化为NaCl,由:
2Na2CO3.NaHCO3+5HCl=5NaCl+3CO2↑+3H2O知:需样品质量:(0.075mol/5)×332 g/mol=4.98 g
设样品中Na2CO3与HCl反应完全转化为NaHCO3(无CO2气体放出),由:
(2Na2CO3.NaHCO3)+2HCl=2NaCl+3NaHCO3知:需样品质量:(0.075mol/2)×332 g/mol=12.45g
讨论:①0<W≤4.98,HCl过量:V(CO2)=(W g/332 g.mol-1×3)×22400 mL.mol-1=202.4W mL
②4.98≤W≤12.45,Na2CO3转化NaHCO3消耗n(HCl)=(W g/332 g.mol-1)×2;剩余n(HCl)= 0.075mol-(Wg/332g.mol-1)×2,生成CO2物质的量等于剩余HCl物质的量,故V(CO2)=[0.075mol-(W g/332 g.mol-1×2)]×22400 mL/mol=(1860mL-134.9W) mL
③W≤12.45,HCl全部用于使Na2CO3转化NaHCO3,故V(CO2)=0。
[答案](1)504 (2)2Na2CO3·NaHCO3·2H2O (3)2.5 (4)①0<W≤4.98 V(CO2)=202.4W mL或V(CO2)= (W g/332 g.mol-1×3)×22400 mL.mol-1;②4.98≤W≤12.45 V(CO2)=1680-134.9W mL或V(CO2)=[0.075mol-(W g/332 g.mol-1×2)]×22400 mL/mol;③12.45≤W V(CO2)=0
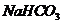 杂质的
杂质的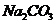 样品的纯度,现将
样品的纯度,现将 克
克 g,,则该样品的纯度(质量分数)是
g,,则该样品的纯度(质量分数)是 B.
B.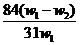 C.
C. D.
D.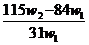
 Na2CO3 + CO2↑
+ H2O m (减少)
Na2CO3 + CO2↑
+ H2O m (减少) ,将其带入下式可得: w(Na2CO3)=
(w1- x )/W1 =
,将其带入下式可得: w(Na2CO3)=
(w1- x )/W1 =  ,A项正确。
,A项正确。 例13.(09江苏卷
例13.(09江苏卷
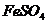 溶液中加入 ▲
(填字母),以除去溶液中的
溶液中加入 ▲
(填字母),以除去溶液中的 。
。
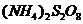 (过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。
(过二硫酸铵)。电解时均用惰性电极,阳极发生地电极反应可表示为
。 2S2O82-
2S2O82-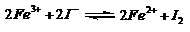 设计成如右图所示的原
设计成如右图所示的原

 ,含
,含 、
、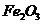 、MgO等杂质)中提取两种工艺品的流程如下:
、MgO等杂质)中提取两种工艺品的流程如下:
 的离子方程式为________.
的离子方程式为________.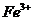 ,可取少量滤液并加入________(填试剂名称)。
,可取少量滤液并加入________(填试剂名称)。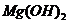 的容度积常数
的容度积常数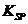 =5.6×
=5.6× ,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的
,取适量的滤液B,加入一定量的烧碱达到沉淀溶液平衡,测得PH=13.00,则此温度下残留在溶液中的 =_______.
=_______.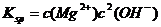 ,
,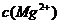 =5.6×10-12/(0.1)2=5.6×10-10。
=5.6×10-12/(0.1)2=5.6×10-10。 Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O
Al(OH)3(胶体)+3H+,利用Al(OH)3(胶体)的吸附性进行净水;B项,是因为轮船主要用铁造外壳,铁在海水中易被腐蚀.镀上比铁活泼的锌,形成原电池,锌作负极,失去电子先被腐蚀,从而起到保护铁的作用,从而可减缓船体的腐蚀速率;氧化镁的熔点是2852℃,可用于制作耐高温材料;电解MgCl2饱和溶液,发生地化学反应为MgCl2+2H2O Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融)
Mg(OH)2+Cl2↑+H2↑,不会产生金属镁,电解熔融的MgCl2能制取单质镁,发生的反应MgCl2(熔融) Z
B 氢化物的沸点:
Z
B 氢化物的沸点:

 的变化图线如图所示,正确的是
的变化图线如图所示,正确的是 A.重力势能和动能之和总保持不变。
A.重力势能和动能之和总保持不变。 大弹性能以及木块的速度V1=3m/S时的弹簧的弹性势能?
大弹性能以及木块的速度V1=3m/S时的弹簧的弹性势能?
