20.(10分)水煤气是重要燃料和化工原料,可用水蒸气通过炽热的炭层制得:
C (s) + H2O(g) CO (g) +H2
(g) △H= +131.3 kJ•mol-1
CO (g) +H2
(g) △H= +131.3 kJ•mol-1
(1)该反应的平衡常数K随温度的升高而___________(增大 / 减小 / 不变)。
(2)上述反应达到平衡后,将体系中的C (s)全部移走,平衡_______________(向左移 / 向右移 / 不移动)。
(3)上述反应在t0时刻达到平衡(如下图),若在t1时刻改变某一条件,请在下图中继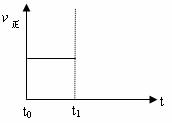 续画出t1时刻之后正反应速率(ν正)随时间的变化:
续画出t1时刻之后正反应速率(ν正)随时间的变化:
① 缩小容器体积(用实线表示)
② 降低温度(用虚线表示)
(4)一定温度下,三个容器中均进行着上述反应,各容器中炭足量,其它物质的物质的量浓度及正逆反应速率关系如下表所示。请填写表中相应的空格。
|
容器编号 |
c(H2O)/mol·L-1 |
c(CO)/mol·L-1 |
c(H2)/mol·L-1 |
ν正、ν逆比较 |
|
I |
0.06 |
0.60 |
0.10 |
ν正=ν逆 |
|
Ⅱ |
0.12 |
0.20 |
________ |
ν正=ν逆 |
|
Ⅲ |
0.10 |
0.20 |
0.40 |
ν正____ν逆 |
(5)CO和H2可合成甲醇。直接甲醇燃料电池(DMFC)由甲醇负极、氧正极和质子交换膜构成。在催化剂作用下甲醇被氧化为水和二氧化碳。甲醇用完后,只要补充甲醇就可以继续使用。因此,DMFC用作笔记本电脑、汽车等的能量来源时,它能够实现污染物的“零排放”。 DMFC的正极电极反应式为 ,DMFC的总反应式为 。
15.(8分)10℃时,在烧杯中加入0.1mol/L的 NaHCO3溶液400mL,加热,测得该溶液的pH发生如下变化:
|
温度(℃) |
10 |
20 |
30 |
50 |
70 |
|
pH |
8.3 |
8.4 |
8.5 |
8.9 |
9.4 |
(1)甲同学认为,该溶液的pH升高的原因是HCO3-的水解程度增大,故碱性增强,该反应的离子方程式为
;
 (2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
(2)乙同学认为,溶液pH升高的原因是NaHCO3受热分解,生成了Na2CO3,并推断Na2CO3的水解程度
(填“大于”或“小于”)NaHCO3 ;
(3)丙同学认为,要确定上述哪种说法合理,只要把加热后的溶液冷却到10℃后再测定溶液pH,若pH________8.3(填“>”、“<”或“=”),说明甲正确,若pH________8.3(填“>”、“<”或“=”),说明乙正确;
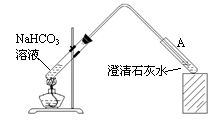
(4)丁同学设计如下实验方案对甲、乙同学的解释进行判断:
实验装置如图,加热煮沸NaHCO3溶液,发现试管A中产生沉淀,说明 (填“甲”或“乙”)推测正确;
(5)将一定体积0.1mol/L的 NaHCO3溶液置于烧杯中加热至微沸(溶液体积不变),测其pH为9.8;将烧杯冷却至室温,过一段时间(溶液体积不变)测得pH为10.1。据此资料可以判断_____(填“甲”或“乙”)推测正确,原因是___________________。
 16.(7分)BaSO4在水中存在沉淀溶解平衡BaSO4(s)
16.(7分)BaSO4在水中存在沉淀溶解平衡BaSO4(s) Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
Ba2+(aq)+SO42-(aq),溶度积常数Ksp=c(Ba2+)·c(SO42-)。
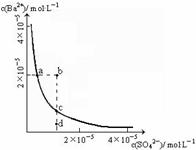
(1)某温度时,BaSO4的沉淀溶解平衡曲线如图所示。
下列说法正确的是___________________
A.加入Na2SO4可以使溶液由a点变到b点
B.通过蒸发可以使溶液由d点变到c点
C.d点无BaSO4沉淀生成
D.a点对应的Ksp大于c点对应的Ksp
(2)在胃部透视时,服用的“钡餐”的主要成分是硫酸钡。在25℃时,硫酸钡的溶度积常数约为1.21×10—10。
①Ba2+是一种有毒的重金属离子,当人体中c(Ba2+)达到2×10—3mol·L-1时,就会对健康产生危害。硫酸钡作为“钡餐”的理由

。
②在25℃时,1L水中约能溶解0.0197g 碳酸钡,且胃液是酸性的, (能/不能)用碳酸钡代替硫酸钡作为“钡餐”,理由是


 四、(本题包括2小题,共23分)
四、(本题包括2小题,共23分)

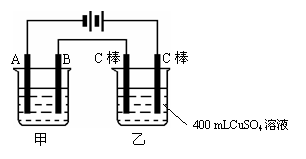 如图为为串联的甲、乙两电解池,试回答:
如图为为串联的甲、乙两电解池,试回答:
 (1)写出Fe2+的基态离子的电子排布式: ;基态碳(C)原子
(1)写出Fe2+的基态离子的电子排布式: ;基态碳(C)原子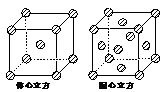 (3)H2O的分子构型为
;H2O分子间能形成氢键的原因是 。
(3)H2O的分子构型为
;H2O分子间能形成氢键的原因是 。 A.CH4 B.CH2=CH2
C.CH≡CH
D.HCHO E.
A.CH4 B.CH2=CH2
C.CH≡CH
D.HCHO E.