网址:http://m.1010jiajiao.com/timu_id_4048655[举报]
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为

(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,
②用相同浓度的盐酸中和两种溶液至中性,
③加水稀释两种溶液至pH为10,
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是______(填序号).
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为______;该条件下反应的平衡常数为______.
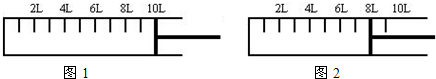
(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,______中水的电离程度大.(填序号,下同)
②用相同浓度的盐酸中和两种溶液至中性,______消耗的盐酸多.
③加水稀释两种溶液至pH为10,______加入的水的体积大.
(1)合成氨工业中采取的下列措施中可用勒夏特列原理解释的是______(填序号).
A.采用较高压强(20~50Mpa) B.采用500℃的高温
C.用铁触媒作催化剂 D.生成的氨液化分离,N2、H2循环压缩到合成塔中
(2)如下图所示,将6mol N2和14mol H2充入一容积可变的密闭容器中发生反应.
反应开始时可滑动的活塞的位置如图1所示,当反应达到平衡时,活塞位置如图2所示.则达到平衡时,N2的转化率为______;该条件下反应的平衡常数为______.
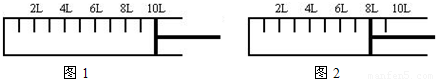
(3)体积为100mL、浓度为0.1mol?L-1的两种溶液:A.NaOH溶液;B.氨水
①两种溶液相比较,______中水的电离程度大.(填序号,下同)
②用相同浓度的盐酸中和两种溶液至中性,______消耗的盐酸多.
③加水稀释两种溶液至pH为10,______加入的水的体积大.
查看习题详情和答案>>
已知 :N2(g)+3H2(g) ![]() 2NH3(g) ΔH=-92 kJ·mol-1。
2NH3(g) ΔH=-92 kJ·mol-1。
(1) 在500℃、2.02×107Pa和铁催化条件下2L密闭容器中充入1molN2和3mol H2,10 min时达到平衡,有0.2 mol NH3生成,则10 min内用氢气表示的该反应的平均速率v(H2)为 ,H2的转化率为__________。
(2)充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是
。
(3)为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.不断补充氮气 C.恒容下充入He来增大压强
D.升高温度 E.原料气不断循环 F.及时移出氨
(4)氨催化氧化制NO在热的铂铑(Pt-Rh)合金催化下进行,反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为________________ ,当升高温度时,K值______(填“增大”、“减小”、“不变”)。NH3转化率在温度T1下随反应时间(t)的变化如右图:其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下NH3转化率随反应时间变化的预期结果示意图。

已知 :N2(g)+3H2(g) 2NH3(g) ΔH=-92 kJ·mol-1。
(1) 在500℃、2.02×107Pa和铁催化条件下2L密闭容器中充入1molN2和3mol H2,10 min时达到平衡,有0.2 mol NH3生成,则10 min内用氢气表示的该反应的平均速率v(H2)为 ,H2的转化率为__________。
(2)充分反应后,放出的热量______(填“<”“>”“=”)92.4kJ,理由是
。
(3)为有效提高氢气的转化率,实际生产中宜采取的措施有____________
A.降低温度 B.不断补充氮气 C.恒容下充入He来增大压强
D.升高温度 E.原料气不断循环 F.及时移出氨
(4)氨催化氧化制NO在热的铂铑(Pt-Rh)合金催化下进行,反应过程中合金始终保持红热,该反应的化学平衡常数K的表达式为________________ ,当升高温度时,K值______(填“增大”、“减小”、“不变”)。NH3转化率在温度T1下随反应时间(t)的变化如右图:其他条件不变,仅改变温度为T2(T2大于T1),在答题卡框图中画出温度T2下NH3转化率随反应时间变化的预期结果示意图。
查看习题详情和答案>>