2. 特殊保存的几种试剂
|
类别 |
常见药品 |
有关特性 |
保存方法 |
|
见光易 变质 |
氯水、硝酸、AgNO3、双氧水 |
见光易分解、有强氧化性 |
棕色瓶中,冷暗处,不用橡皮塞 |
|
易燃 |
⑴ 红磷、硫、镁 |
遇火易燃 |
远离火种,单独存放 |
|
⑵ 汽油、苯、乙醇、低级酯 |
易燃有机溶剂 |
远离火种,不用橡皮塞 |
|
|
易爆 |
⑴ KMnO4、KClO3、NH4NO3、KNO3 |
受热易分解,强氧化性 |
远离易燃物,防受热撞击 |
|
⑵ 硝酸纤维、银氨溶液 |
不稳定、易引起爆炸 |
随用随制 |
|
|
强 腐 蚀 性 |
⑴ 液溴 |
易挥发的强氧化剂 |
棕色瓶中,玻璃塞,水封 |
|
⑵ 氢氟酸 |
腐蚀玻璃 |
塑料瓶中 |
|
|
剧毒 |
P4、Hg、HgCl2、可溶钡盐、KCN |
对人和生物有剧毒 |
单独存放、专人管理 |
 CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2
CO+H2,Zn+2HCl=ZnCl2+H2↑ 2C+ SiO2 Si+2CO↑
Si+2CO↑ 2KCN+3H2O;△H=+276kJ/mol ①
2KCN+3H2O;△H=+276kJ/mol ①
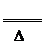 K2S+H2S↑。该反应的化学方程式为KCN+KHS
K2S+H2S↑。该反应的化学方程式为KCN+KHS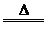 MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O 2H2O+2S
2H2O+2S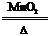 2KCl+3O2↑ CH4
2KCl+3O2↑ CH4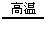 C+2H2 2H2O2
C+2H2 2H2O2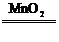 2H2O+O2↑
2H2O+O2↑ 2NaOH+Cl2↑+H2↑
2NaOH+Cl2↑+H2↑