25.(10分)
用50 mL 0.50mol·L-1盐酸与50 mL 0.55 mol·L-1 NaOH溶液,在如图所示的装置中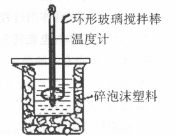 进行中和反应,测定强酸与强碱反应的反应热。
进行中和反应,测定强酸与强碱反应的反应热。
|
|
起始温度t1/℃ |
终止温度t2/℃ |
温度差 (t2-t1)/℃ |
||
 |
 |
平均值 |
|||
|
1 |
25.5 |
25.0 |
25.25 |
28.5 |
3.25 |
|
2 |
24.5 |
24.2 |
24.45 |
27.6 |
3.15 |
|
3 |
25.0 |
24.5 |
24.75 |
26.5 |
1.75 |
(1)在该实验中,量取50 mL盐酸或NaOH溶液,需要用到的玻璃仪是 ;
(2)装置中大、小烧杯之间填满碎泡沫塑料的目的是 ;
(3)某同学实验记录的数据如上表所示,其中记录的终止温度是指 温度;
(4)计算该实验发生中和反应时放出的热量为 kJ[中和后生成的溶液的比热容c=4.18 J·(g·℃)-1,稀溶液的密度都为1 g·cm-3];
(5)如果用50 mL 0.55 mol·L一的氨水(NH3·H2O)代替NaOH溶液进行上述实验,通过测得的反应热计算中和热,其中和热△H会偏大,其原因是 。
24.(15分)
工来合成氨与制备硝酸一般可连续生产,流程如下:
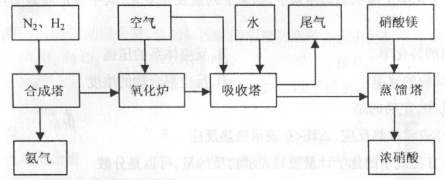
(1)工来生产时,制取氢气的一个反应为: ,
,
①t℃时,往l L密闭容器中充人0.2 mol CO和0.3 mol水蒸气,反应建立平衡后,体系中c(H2)=0.12 mol·L-1,该温度下此反应的平衡常数K= ;
②保持温度不变,向上述平衡体系中再加入0.1 mol CO,当反应重新建立平衡时,水蒸气的总转化率 (H2O)=
。
(H2O)=
。
|
T(K) |
T1 |
573 |
T2 |
|
K |
1.00×107 |
2.45×105 |
1.88×103 |
(2)合成塔中发生反应为:

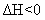
右表为不同温度下该反应的平衡常数。由此可推知,表中T1 573K(填“>”、“<”或“=”)。
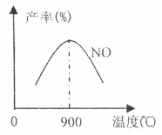
(3)NH3和O2在铂系催化剂作用下从145℃就开始反应:
4NH3+5O2 NO+6H2O AH=-905kJ·mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因
NO+6H2O AH=-905kJ·mol-1,不同温度下NO产率如图所示,温度高于900℃时,NO产率下降的原因
。
(4)吸收塔中反应为:3NO2+H2O 2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
2HNO3+NO。从生产流程看,吸收塔中需要补充空气,其原因是
 (5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮氧化物还原为氮气和水,其反应机理为:
(5)硝酸厂的尾气含有氮氧化物,不经处理直接排放将污染空气。目前科学家探索利用燃料气体中的甲烷将氮氧化物还原为氮气和水,其反应机理为:
CH4(g)+4NO2(g)=4NO(g)+CO2(g)+2H2O(g)  H=-574kJ·mol-1。;
H=-574kJ·mol-1。;
CH4(g)+4NO(g)=2N2(g)+CO2(g)+2H2O(g)  H=-1160 kJ·mol-1;
H=-1160 kJ·mol-1;
则甲烷直接将NO2还原为N2的热化学方程式为: 。
 B.
B.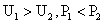 C.
C.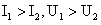 D.
D.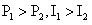
 键和 个
键和 个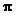 键;
键;