3、硫的氧化物
(1)二氧化硫:
①SO2是无色而有刺激性气味的有毒气体,密度比空气大,容易液化,易溶于水。
②SO2是酸性氧化物,能跟水反应生成亚硫酸,亚硫酸是中强酸。
③SO2有强还原性 常见氧化剂(见上)均可与SO2发生氧化一还原反应
如:SO2 + Cl 2 +2H2O == H2SO4 + 2HCl
④SO2也有一定的氧化性 2H2S + SO2 == 3S↓ +2H2O
⑤SO2具有漂白性,能跟有色有机化合物生成无色物质(可逆、非氧化还原反应)
⑥实验室制法:Na2SO3 + H2SO4(浓) == Na2SO3 + H2O +SO2↑
或Cu + 2H2SO4(浓)  CuSO4 + 2H2O + SO2↑
CuSO4 + 2H2O + SO2↑
(2)三氧化硫:是一种没有颜色易挥发的晶体;具有酸性氧化物的通性,遇水剧烈反应生成硫酸并放出大量的热。
(3)比较SO2与CO2、SO3
|
|
SO2 |
CO2 |
SO3 |
||
|
主要物性 |
无色、有刺激性气体、易液化易溶于水(1:40) |
无色、无气味气体能溶于水(1:1) |
无色固体.熔点(16.8℃) |
||
|
与水反应 |
 SO2+H2O H2SO3 中强酸 SO2+H2O H2SO3 中强酸 |
 CO2+H2O H2CO2
弱酸 CO2+H2O H2CO2
弱酸 |
SO3+H2O==H2SO4(强酸) |
||
|
与碱反应 |
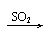 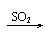 Ca(OH)2 CaSO3↓ Ca(HSO3)2 清液 白 清液 |
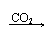 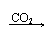 Ca(OH)2 CaCO3↓ Ca(HCO3)2 清液 白↓ 清液 |
SO3+Ca(OH)2==CaSO4(微溶) |
||
|
紫色石蕊 |
变红 |
变红 |
变红 |
||
|
品红 |
褪色 |
不褪色 |
不褪色 |
||
|
鉴定存在 |
能使品红褪色 又能使清石灰变浑浊 |
不能使品红褪色 但能使清石灰水变浑浊 |
|
||
|
氧化性 |
SO2+2H2S=2S↓+2H2O |
 CO2+2Mg
点燃 2MgO+C CO2+2Mg
点燃 2MgO+C
|
|
||
|
还原性 |
有 |
无 |
|
||
|
与Na2O2作用 |
Na2O2+SO2==Na2SO4 |
2Na2O2+2CO2==2Na2CO3+O2 |
2Na2O2+2SO3==2NaSO4+O2↑ |
(4)酸雨的形成和防治
酸雨的形成是一个十分复杂的大气化学和大气物理过程。酸雨中含有硫酸和硝酸等酸性物质,其中又以硫酸为主。从污染源排放出来的SO2、NOx(NO、NO2)是酸雨形成的主要起始物,因为大气中的SO2在光照、烟尘中的金属氧化物等的作用下,经氧化、溶于水等方式形成H2SO4,而NO被空气中氧气氧化为NO2,NO2直接溶于水形成HNO3,造成了雨水pH值降低,便形成了酸雨。
硫酸型酸雨的形成过程为:气相反应:2SO2+O2=2SO3、SO3+H2O=H2SO4;液相反应:SO2+H2O=H2SO3、2H2SO3+O2=2H2SO4。总反应: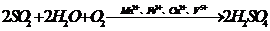
硝酸型酸雨的形成过程为:2NO+O2=2NO2、3NO2+H2O=2HNO3+NO。
引起硫酸型酸雨的SO2人为排放主要是化石燃料的燃烧、工业尾气的排放、土法炼硫等。引起硝酸型酸雨的NOx人为排放主要是机动车尾气排放。
酸雨危害:①直接引起人的呼吸系统疾病;②使土壤酸化,损坏森林;③腐蚀建筑结构、工业装备,电信电缆等。
酸雨防治与各种脱硫技术:要防治酸雨的污染,最根本的途径是减少人为的污染物排放。因此研究煤炭中硫资源的综合开发与利用、采取排烟脱硫技术回收二氧化硫、寻找替代能源、城市煤气化、提高燃煤效率等都是防止和治理酸雨的有效途径。目前比较成熟的方法是各种脱硫技术的应用。
在含硫矿物燃料中加生石灰,及时吸收燃烧过程中产生的SO2,这种方法称为“钙基固硫”,其反应方程式为:SO2+CaO=CaSO3,2CaSO3+O2=2CaSO4;也可采用烟气脱硫技术,用石灰浆液或石灰石在烟气吸收塔内循环,吸收烟气中的SO2,其反应方程式为:SO2+Ca(OH)2=CaSO3+H2O,SO2+CaCO3=CaSO3+CO2,2CaSO3+O2=2CaSO4。在冶金工业的烟道废气中,常混有大量的SO2和CO,它们都是大气的污染物,在773K和催化剂(铝矾土)的作用下,使二者反应可收回大量的硫黄,其反应原理为:SO2+2CO==S+CO2
3、卤素间的置换反应及X-离子的检验:
(1)Cl2 + 2Br- = Br2 + 2Cl-
Cl2 + 2I- = I2 + 2Cl-
Br2 + 2I- = I2 + 2Br-
结论:氧化性:Cl2 > Br2 > I2; 还原性:I- > Br- > Cl-
(2)溴和碘在不同溶剂中所生成溶液(由稀到浓)的颜色变化
 溶剂 溶剂溶质 |
水 |
苯 |
汽 油 |
四氯化碳 |
|
Br2 |
黄
→ 橙 |
橙
→ 橙红 |
橙 → 橙红 |
橙→
橙红 |
|
I2 |
深黄→
褐 |
淡紫 → 紫红 |
淡紫→
紫红 |
紫→
深紫 |
 密
度 密
度 |
|
比 水 轻 |
比 水 轻 |
比 水 重 |
(3)X-离子的检验
 Cl-
白色沉淀
Cl-
白色沉淀
 Br- + AgNO3 +
HNO3
浅黄色沉淀
Br- + AgNO3 +
HNO3
浅黄色沉淀
I- 黄色沉淀
1、卤素及化合物的性质比较:
|
|
|
氟 |
氯 |
溴 |
碘 |
|
单质物理性质 |
状态 |
气 |
气(易液化) |
液(易挥发) |
固(易升华) |
|
熔、沸点 |
熔、沸点逐渐升高 |
||||
|
颜色 |
淡黄绿色 |
黄绿色 |
红棕色 |
紫黑色 |
|
|
密度 |
密度逐渐增大 |
||||
|
X2与H2化合 |
条件 |
冷暗处 |
光照 |
加热 |
持续加热 |
|
程度 |
剧烈爆炸 |
爆炸 |
缓慢 |
化合同时分解 |
|
|
X2与H2O化合 |
反应 |
2F2+2H2O=4HF+O2 |
X2 + H2O = HX + HXO |
||
|
程度 |
剧烈 |
缓慢 |
微弱 |
极弱 |
|
|
水溶性 |
|
反应生成氢氟酸 |
水溶性依次减小,有机溶剂中溶解性依次增大 |
||
|
化合价 |
|
只有-1价 |
有-1、+1、+3、+5、+7等 |
||
|
含氧酸 |
化学式 |
无含氧酸 |
有HXO、HXO2、HXO3、HXO4等 |
||
|
强弱程度 |
|
同一价态的酸性依次减弱 |
|||
|
卤化银 |
颜色 |
AgF(白) |
AgCl(白) |
AgBr(淡黄) |
AgI(黄) |
|
水溶性 |
易溶 |
均难溶,且溶解度依次减小 |
|||
|
感光性 |
难分解 |
见光均易分解,且感光性逐渐增强 |

 澄清液
澄清液 白色沉淀(说明待测液中含有SO42-离子)
白色沉淀(说明待测液中含有SO42-离子) A.可燃性: 2H2S+O2
点燃 2S+2H2O(H2S过量)
A.可燃性: 2H2S+O2
点燃 2S+2H2O(H2S过量) 2H2S+3O2
点燃 2SO2+2H2O(O2过量)
2H2S+3O2
点燃 2SO2+2H2O(O2过量) 2Al+3S
2Al+3S Fe+S △ FeS(黑色)
Fe+S △ FeS(黑色) S+H2 △ H2S(说明硫化氢不稳定)
S+H2 △ H2S(说明硫化氢不稳定) S+6HNO3(浓) △ H2SO4+6NO2↑+2H2O
S+6HNO3(浓) △ H2SO4+6NO2↑+2H2O S+2H2SO4(浓) △ 2SO2↑+2H2O
S+2H2SO4(浓) △ 2SO2↑+2H2O 3S+6NaOH △ 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)
3S+6NaOH △ 2Na2S+Na2SO3+3H2O(用热碱溶液清洗硫)