网址:http://m.1010jiajiao.com/timu_id_3982717[举报]
| |||||||||||||||

实验步骤:
(1)把30% NaOH溶液和废铁屑混合、煮沸、冷却,用清水洗净废铁屑。将洗涤铁屑后的NaOH溶液装入F中。
(2)在E中用处理过的Fe屑和稀H2SO4反应制取FeSO4。
(3)将硫酸亚铁溶液与硫酸铵溶液混合,结晶得摩尔盐。
试回答下列问题:
(1)F中的NaOH溶液的主要作用是____________________________________________。
(2)Fe屑和稀H2SO4反应产生的氢气可赶走装置中的氧气及(NH4)2SO4溶液中的溶解氧,操作时应先关闭活塞______________,并同时打开活塞______________。
请写出Fe屑和稀H2SO4反应产生的氢气的另外一个作用____________________________。
(3)使摩尔盐结晶可采取两种方法:①蒸发溶液,再自然冷却结晶;②不蒸发溶液,直接自然冷却结晶。你认为较好的方法是______________。(填序号)
(4)原料利用率高,副产品少,产生的有害废物少,保护环境是“绿色化学”的主要内涵。请写出此实验中能体现“绿色化学”的具体做法(至少写出两点):
_______________________________________、______________________________________。
查看习题详情和答案>>垃圾是放错地方的资源,工业废料也可以再利用。某化学兴趣小组在实验室中用废弃含有铝、铁、铜的合金制取硫酸铝溶液、硝酸铜晶体和铁红(Fe2O3)。其实验方案如下:
 (1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
(1)写出滤液A中加入足量硫酸后所发生反应的离子方程式:
写出滤渣B中发生反应的离子方程式:
(2)已知Fe(OH)3沉淀的pH是2~3.2,溶液C通过调节pH可以使Fe3+沉淀完全。下列物质中,可用作调整溶液C的pH的试剂是 (填序号)
A.铜粉 B.氨水 C.氧化铜 D.氢氧化铜
(3)利用滤液D制取硝酸铜晶体,必须进行的实验操作步骤:加热浓缩、冷却结晶、
(填操作名称)、自然干燥。
(4)选用提供的试剂,设计实验验证铁红中是否含有FeO。
提供的试剂:a.稀盐酸 b.稀硫酸 c.KSCN溶液 d.KMnO4溶液 e.NaOH溶液 f.碘水
所选用的试剂为 (填序号);证明铁红中含有FeO的实验现象为 。
(5)在0.1L的混合酸溶液中,c(HNO3)=2mol·L-1,c(H2SO4)=3mol·L-1,将0.3mol的铜放入并充分反应后,被还原的HNO3的物质的量为 。
查看习题详情和答案>> 镁、铝、铁及其化合物在生产和生活中有广泛的应用.
镁、铝、铁及其化合物在生产和生活中有广泛的应用.
(1)镁铝合金用在飞机制造业,现有3.90克镁铝合金溶于足量的2mol/L稀硫酸中生成0.2mol氢气,计算并确定镁铝合金中物质的量n(Mg):n(Al)=______.
(2)硫铁矿的主要成分为FeS2(假设杂质只含SiO2)是生产硫酸的原料.取某硫铁矿10g在足量的空气中煅烧(4FeS2+11O2→2Fe2O3+8SO2),充分反应后冷却,称得固体质量为7.4g(杂质SiO2不反应).该硫铁矿中FeS2的质量分数为______.
(3)现有一定量的铁粉和铝粉组成的混合物跟100mL稀硝酸充分反应,反应过程中无任何气体放出,往反应后的澄清溶液中逐渐加入4.00mol?L-1的NaOH溶液,加入NaOH溶液的体积与产生沉淀的质量的关系如图所示(必要时可加热,忽略气体在水中的溶解):纵坐标中A点的数值是______
(4)炼铁厂生产的生铁常用于炼钢.取某钢样粉末28.12g(假设只含Fe和C),在氧气流中充分反应,得到CO2气体224mL(标准状况下).
①计算此钢样粉末中铁和碳的物质的量之比为______(最简单的整数比).
②再取三份不同质量的上述钢样粉末分别加到100mL相同浓度的稀H2SO4中,充分反应后,测得的实验数据如表所示:
| 实验序号 | I | II | III |
| 加入钢样粉末的质量(g) | 2.812 | 5.624 | 8.436 |
| 生成气体的体积(L)(标准状况) | 1.120 | 2.240 | 2.800 |
③若在上述实验II中继续加入m克钢样粉末,计算反应结束后剩余的固体质量为______ g(保留3位小数) 查看习题详情和答案>>
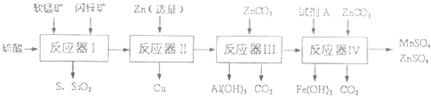
已知:ZnCO3不溶于水,但溶于酸.部分阳离子以氢氧化物形式深沉时溶液的pH见下表:
| 物质 | Fe(OH)3 | A1(OH)3 | Zn(OH)2 | Fe(OH)2 | Mn(OH)2 |
| 开始沉淀pH | 2.7 | 3.3 | 5.4 | 7.6 | 8.3 |
| 完全沉淀pH | 4.4 | 5.2 | 8.0 | 9.6 | 9.8 |
(1)反应器I过滤所得滤液中含有MnSO4、ZnSO4、CuSO4、Fe2(SO4)3、A12(CO4)3等.试完成反应器I中生成CuSO4的化学方程式(不须配平):CuS+
(2)反应器II中发生反应的离子方程式为
(3)从沉淀溶解平衡的角度分析反应器III中生成A1(OH)3沉淀的原因
(4)反应器中IV中,试剂A可以是下列物质中
(5)欲从反应器IV的滤液中完全沉淀出Zn(OH)2,而不析出Mn(OH)2,则滤液的pH范围为
