【题目】高纯硫酸锰作为合成镍钴锰三元正极材料的原料,工业上可由天然二氧化锰粉与硫化锰矿(还含Fe、Al、Mg、Zn、Ni、Si等元素)制备,工艺如图所示。回答下列问题:

相关金属离子[c0(Mn+)=0.1mol·L1]形成氢氧化物沉淀的pH范围如下:
金属离子 | Mn2+ | Fe2+ | Fe3+ | Al3+ | Mg2+ | Zn2+ | Ni2+ |
开始沉淀的pH | 8.1 | 6.3 | 1.5 | 3.4 | 8.9 | 6.2 | 6.9 |
沉淀完全的pH | 10.1 | 8.3 | 2.8 | 4.7 | 10.9 | 8.2 | 8.9 |
(1)“滤渣1”含有S和___;在稀硫酸“溶浸”中二氧化锰与硫化锰发生氧化还原反应,还原剂是__,写出化学方程式___。
(2)“氧化”中添加适量的MnO2的作用是__。
(3)“调pH”除铁和铝,溶液的pH范围应调节为__~6之间。
(4)“除杂1”的目的是除去Zn2+和Ni2+,“滤渣3”的主要成分是__。
(5)“除杂2”的目的是生成MgF2沉淀除去Mg2+。若溶液酸度过高,Mg2+沉淀不完全,原因是__。
(6)写出“沉锰”的离子方程式__。
(7)工业上常用NH4HCO3做金属离子的沉淀剂,而不用Na2CO3或NaHCO3,其优点是NH4HCO3溶解度大,容易洗涤,过量时受热易分解,便于分离除去。写出分解的化学方程式__
【题目】测定0.1 mol·L-1 Na2SO3溶液先升温再降温过程中的pH,数据如下。
时刻 | ① | ② | ③ | ④ |
温度/℃ | 25 | 30 | 40 | 25 |
pH | 9.66 | 9.52 | 9.37 | 9.25 |
实验过程中,取①④时刻的溶液,加入盐酸酸化的BaCl2溶液做对比实验,④产生白色沉淀多。
下列说法不正确的是
A. Na2SO3溶液中存在水解平衡:![]() +H2O
+H2O![]()
![]() +OH
+OH
B. ④的pH与①不同,是由于![]() 浓度减小造成的
浓度减小造成的
C. ①→③的过程中,温度和浓度对水解平衡移动方向的影响一致
D. ①与④的Kw值相等
【题目】A、B、C、D、E是元素周期表中五种常见元素,其原子序数依次增大。详细信息见表:
① | A的一种核素在考古时常用来鉴定一些文物的年代 |
② | B的氧化物是导致光化学烟雾的主要物质之一 |
③ | C的某一种单质是空气的主要成分之一 |
④ | D的基态原子核外有6个原子轨道处于半充满状态 |
⑤ | E能形成红色的E2O和黑色的EO两种氧化物 |
请回答下列问题:
(1)D的价电子排布式可表示为__。
(2)BC3-的空间构型为__(用文字描述)。
(3)根据等电子原理,AC分子的结构式为__。
(4)1molAC2中σ键、π键数目之比为__。
(5)A、B、C的第一电离能由大到小顺序为__。
(6)E为__堆积金属,已知E原子的半径为acm,阿伏加德罗常数的值为NA,则E晶体的密度是__g·cm-3。(列出算式即可)。
(7)E晶胞结构如图所示,E晶体中每个E原子周围距离最近的E原子数目为__;E2S为半导体材料,在其立方晶胞内部有4个S原子,其余S原子位于面心和顶点,则该晶胞中有__个E原子。
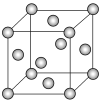
(8)将E单质的粉末加入NH3的浓溶液中,通入O2,充分反应后溶液呈深蓝色,写出该反应的离子方程式__。