题目内容
【题目】常温下,有浓度均为![]() 的下列四种溶液:
的下列四种溶液:
①![]() 溶液 ②
溶液 ②![]() 溶液 ③
溶液 ③![]() 溶液 ④
溶液 ④![]() 溶液
溶液
(1)这四种溶液pH由大到小的顺序是______,其中由水电离的![]() 浓度最小的是______。(均填序号)
浓度最小的是______。(均填序号)
(2)②中各离子浓度由大到小的顺序是__________,![]() 的水解平衡常数
的水解平衡常数![]() ______
______![]() 。(已知碳酸的电离常数
。(已知碳酸的电离常数![]() )
)
(3)向③中通入少量氨气,此时 的值________(填“增大”、“减小”或“不变”)。
的值________(填“增大”、“减小”或“不变”)。
(4)若将③和④混合后溶液恰好呈中性,则混合前③的体积______④的体积(填“大于”、“小于”或“等于”)。
【答案】④②③① ① ![]()
![]() 减小 大于
减小 大于
【解析】
1)酸和碱溶液抑制了水的电离,盐溶液促进了水的电离,酸或者碱溶液中氢离子、氢氧根离子浓度越大,水的电离程度越小,据此进行解答;
(2)碳酸氢钠溶液呈碱性,说明碳酸氢根的水解程度大于电离程度,结合水的电离写出酸氢钠溶液中离子浓度大小顺序;根据![]() 进行计算;
进行计算;
(3)通过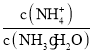 与平衡常数之间的关系判断;
与平衡常数之间的关系判断;
(4)先比较等体积混合后溶液的酸碱性,然后判断溶液显示中性时二者体积关系;
(1)④是强碱,溶液中![]() ,①是二元强酸,溶液中
,①是二元强酸,溶液中![]() ,二者均抑制水的电离,①抑制程度大。故答案为:④②③⑤①;①;
,二者均抑制水的电离,①抑制程度大。故答案为:④②③⑤①;①;
(2)依据![]() 、
、![]()
![]()
![]() (程度大)、
(程度大)、![]()
![]()
![]() (程度小)、
(程度小)、![]()
![]()
![]() 可知溶液中各离子浓度大小;
可知溶液中各离子浓度大小;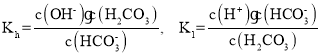 可知
可知![]() 。故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);2.5×10-8;
。故答案为:c(Na+)>c(HCO3-)>c(OH-)>c(H+)>c(CO32-);2.5×10-8;
(3) 一水合氨的电离平衡常数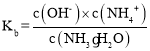 ,所以
,所以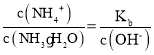 ,通入氨气后,溶液中氢氧根离子浓度增大,该比值减小,故答案为:减小
,通入氨气后,溶液中氢氧根离子浓度增大,该比值减小,故答案为:减小
(4)如果等体积混合,恰好完全反应生成![]() ,溶液显碱性,所以
,溶液显碱性,所以![]() 过量。故答案为:大于;
过量。故答案为:大于;

练习册系列答案
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案
相关题目