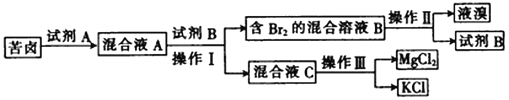
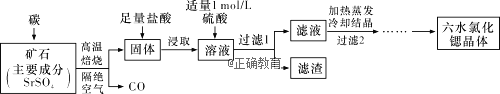
题目内容
【题目】H是合成抗炎药洛索洛芬钠的关键中间体,它的一种合成路线如下:
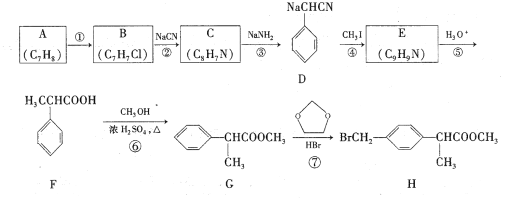
回答下列问题:
(1)A的名称是____,H中官能团名称是____;
(2)反应①的反应条件为____;
(3)反应⑥的化学方程式为________;反应类型为____。
(4)反应⑦除生成H外,还生成了另一种有机产物的结构简式为____。
(5)符合下列条件的G的同分异构体有____种。
I.能发生银镜反应 Ⅱ.苯环上一氯取代物只有一种 Ⅲ.核磁共振氢谱有4组峰
(6)仿照H的合成路线,设计一种由B合成![]() 的合成路线___。
的合成路线___。
【答案】 甲苯 酯基、溴原子 光照  取代反应 HOCH2CH2OH 4
取代反应 HOCH2CH2OH 4 
【解析】分析:由A、B、C的分子式,结合D的结构简式,根据转化关系可知,A为甲苯,A中甲基上的氢原子被氯原子取代生成B为![]() ,B发生取代反应生成C为
,B发生取代反应生成C为![]() ;对比D、F结构可知,D发生取代反应生成E为
;对比D、F结构可知,D发生取代反应生成E为 ,E发生水解反应生成F,F与甲醇发生酯化反应生成G,G发生取代反应得到H,同时还生成乙二醇,据此解答。
,E发生水解反应生成F,F与甲醇发生酯化反应生成G,G发生取代反应得到H,同时还生成乙二醇,据此解答。
详解:(1)根据以上分析可知A的名称是甲苯,根据H的结构简式可知H中官能团名称是酯基、溴原子;
(2)反应①是甲基上的氢原子被氯原子取代,则反应条件为光照;
(3)根据以上分析可知反应⑥是F与甲醇发生的酯化反应,反应的化学方程式为 ;
;
(4)根据原子守恒可知反应⑦除生成H外,还生成乙二醇,结构简式为HOCH2CH2OH;
(5)符合下列条件的G的同分异构体中能发生银镜反应,说明含有醛基;苯环上一氯取代物只有一种,说明苯环上只有一类氢原子;核磁共振氢谱有4组峰,说明苯环上取代基的氢原子还有3类,因此符合条件的有机物结构简式为 ,共计是4种;
,共计是4种;
(6)根据已知信息结合逆推法可知由B合成![]() 的合成路线为
的合成路线为 。
。

 优翼小帮手同步口算系列答案
优翼小帮手同步口算系列答案【题目】25℃时,有关物质的电离平衡常数如下:
化学式 | CH3COOH | H2CO3 | H2SO3 |
电离平衡常数 | K=1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | K1=1.5×10-2 K2=1.02×10-7 |
(1)请写出H2SO3的电离平衡常数K1的表达式:________________。
(2) 常温下,将体积为10mL pH=2的醋酸溶液与亚硫酸溶液分别加蒸馏水稀释至1000mL,稀释后溶液的pH,前者_____后者(填“>”、“<”或“=”)。
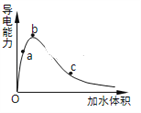
(3)一定条件下,冰醋酸加水稀释过程中溶液导电能力I随加水体积V变化曲线如右图所示,则a、b、c三点溶液醋酸的电离程度由大到小为____________________。
(4)下列离子CH3COO-、CO32-、HSO3-、SO32-在溶液中结合H+的能力由大到小的关系为___________。
(5)体积相同、c(H+)相同的①CH3COOH;②HCl;③H2SO4 三种酸溶液分别与同浓度的NaOH溶液完全中和时,消耗NaOH溶液的体积由大到小的排列顺序是_____(填序号)。
(6)已知,H+(aq) + OH-(aq) == H2O(l) ΔH =-57.3 kJ/mol。实验测得稀醋酸与稀NaOH溶液反应生成1 mol H2O时放出57 kJ的热,则醋酸溶液中,醋酸电离的热化学方程式为________________。
【题目】下列对如图所示装置实验现象的描述正确的是( )
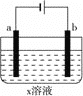
a电极 | b电极 | x溶液 | 实验现象 | |
A | 石墨 | 石墨 | CuCl2 | a极质量增加,b极放出无色气体 |
B | Fe | 石墨 | KNO3 | a极质量增加,b极放出无色气体 |
C | Fe | Cu | CuSO4 | a极质量增加,b极质量减少 |
D | 石墨 | 石墨 | HCl | a、b极都放出无色气体 |
A. A B. B C. C D. D
【题目】温度为T时,向4L恒容密闭容器中充入2 mol PCl5,反应PCl5(g)![]() PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
PCl3(g)+Cl2(g)经一段时间后达到平衡。反应过程中测定的部分数据见下表:
t/s | 0 | 50 | 150 | 250 | 350 |
n(PCl3)/mol | 0 | 0.32 | 0.38 | 0.40 | 0.40 |
下列说法正确的是 ( )
A. 反应在前50 s的平均速率为v(PCl3)=0.006 4 mol·L-1·s-1
B. 保持其他条件不变,升高温度,平衡时c(PCl3)=0.11 mol·L-1,则反应的ΔH<0
C. 相同温度下,起始时向容器中充入4 mol PCl3、4 mol Cl2,达到平衡时,则此反应的化学平衡常数为0.025
D. 相同温度下,起始时向容器中充入2.0 mol PCl5、0.40 mol PCl3和0.40 mol Cl2,达到平衡前v(正)<v(逆)