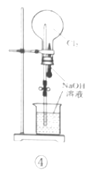
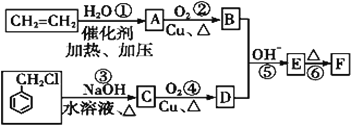
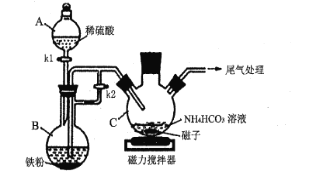
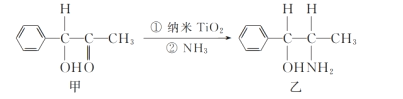
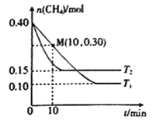
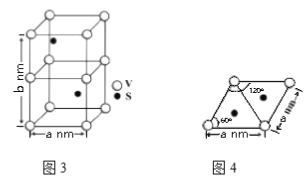
0 199899 199907 199913 199917 199923 199925 199929 199935 199937 199943 199949 199953 199955 199959 199965 199967 199973 199977 199979 199983 199985 199989 199991 199993 199994 199995 199997 199998 199999 200001 200003 200007 200009 200013 200015 200019 200025 200027 200033 200037 200039 200043 200049 200055 200057 200063 200067 200069 200075 200079 200085 200093 203614