题目内容
【题目】氮的化合物应用广泛,但氮氧化物是重要的空气污染物,应降低其排放。
(1)用CO2和NH3可合成氮肥尿素[CO(NH2)2]
已知:①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-151.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+120.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
用CO2和NH3合成尿素(副产物是液态水)的热化学方程式为______________________
(2)工业上常用如下反应消除氮氧化物的污染:CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H,在温度为T1和T2时,分别将0.40molCH4和0.9molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
N2(g)+CO2(g)+2H2O(g) △H,在温度为T1和T2时,分别将0.40molCH4和0.9molNO2充入体积为1L的密闭容器中,n(CH4)随反应时间的变化如图所示:
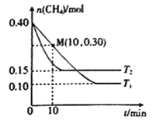
①根据图判断该反应的△H______0(填“>”、“<”或“=”)。
②温度为T1时,0~10min内NO2的平均反应速率v(NO2)=__________,反应的平衡常数K=_________ 。
③该反应达到平衡后,为在提高反应速率同时提高NO2的转化率,可采取的措施有______(填标号)。
A.改用高效催化剂 B.增加CH4的浓度 C.缩小容器的体积 D.升高温度
(3)利用原电池反应可实现NO2的无害化,总反应为6NO2+8NH3=7N2+12H2O,电解质溶液为HCl溶液,工作一段时间后,负极的电极反应式为________________。
(4)氮的一种氢化物HN3,其水溶液酸性与醋酸相似,则NaN3溶液中各离子浓度由大到小的顺序为________________;常温下,将amol/L的Ba(OH) 2 与bmol/L的HN3溶液等体积混合,充分反应后,溶液中存在2c(Ba2+)=c(N3-),则该溶液中c(HN3)=_________ mol/L。
【答案】2NH3(g) +CO2(g)=CO(NH2)2(s)+ H2O (l) △H=-75kJ/mol < 0.02 mol ·L-1·min-1 3.6 B 2NH3 - 6e- = N2 + 6H+ c(Na+)>c(N3﹣)>c(OH-)>c(H+) (0.5b-a)
【解析】
(1)结合盖斯定律计算①+②③得到CO2和NH3合成尿素(副产物是液态水)的热化学方程式;
(2)①先拐先平温度高,升高温度甲烷物质的量增大,说明升温平衡逆向移动;
②温度T1时,0~10min内NO2的平均反应速率v=![]() ,平衡常数K=
,平衡常数K= ![]() ;
;
③提高反应速率同时提高NO2的转化率,增大反应速率同时平衡正向进行,结合化学平衡移动原理和反应特征分析判断;
(3)正极上是二氧化氮得到电子发生还原反应,负极上是氨气失电子发生氧化反应,结合电极反应分析判断;
(4)NaN3溶液中N3水解,溶液呈碱性,结合溶液中电荷守恒分析溶液中离子浓度大小顺序;结合反应2HN3+Ba(OH)2=Ba(N3)2+2H2O的定量关系计算剩余HN3物质的量得到溶液中HN3浓度。
(1)①2NH3(g)+CO2(g)=NH2CO2NH4 (s) △H=-151.5 kJ·mol-1
②NH2CO2NH4(s)=CO(NH2)2(s)+H2O(g) △H=+120.5 kJ·mol-1
③H2O(l)=H2O(g) △H=+44 kJ·mol-1
结合盖斯定律计算①+②③得到CO2和NH3合成尿素(副产物是液态水)的热化学方程式:2NH3(g) +CO2(g)=CO(NH2)2(s)+ H2O (l) △H=-75kJ/mol,
故答案为:2NH3(g) +CO2(g)=CO(NH2)2(s)+ H2O (l) △H=-75kJ/mol;
(2)CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g) △H,
N2(g)+CO2(g)+2H2O(g) △H,
①结合图像分析,先拐先平温度高,即T2>T1,温度越高甲烷物质的量越大,证明升温平衡逆向进行,正反应为为放热反应,△H<0,
故答案为:<;
②温度T1时,0~10min内,甲烷物质的量减小0.4mol0.3mol=0.1mol,反应的二氧化氮物质的量为0.2mol, NO2的平均反应速率v(NO2)= =0.02 mol ·L-1·min-1,
=0.02 mol ·L-1·min-1,
结合三段式计算平衡浓度得到平衡常数,平衡状态下甲烷物质的量0.1mol,
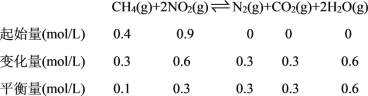
K=![]() =3.6;
=3.6;
③CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),反应为气体体积增大的放热反应,
N2(g)+CO2(g)+2H2O(g),反应为气体体积增大的放热反应,
A、改用高效催化剂增大反应速率不改变化学平衡,转化率不变,故A不符合题意;
B、增加CH4的浓度,反应速率增大,提高NO2的转化率,故B符合题意;
C、缩小容器的体积,增大压强反应速率增大,平衡逆向进行,反应物转化率减小,故C不符合题意;
D、反应为放热反应,升高温度平衡逆向进行,反应速率增大,转化率减小,故D不符合题意;
故答案为:B;
(3)6NO2+8NH3=7N2+12H2O,正极上是二氧化氮得到电子发生还原反应,电极反应为:2NO2+8e+4H2O=N2+8OH,负极上是氨气失电子发生氧化反应,电极反应为:2NH3 - 6e- = N2 + 6H+;
(4)![]() mol/L =(0.5b-a)mol/L。
mol/L =(0.5b-a)mol/L。

【题目】为探究Na与CO2反应的产物,某化学兴趣小组按如图所示装置进行实验。
己知:CO+2Ag(NH3)2OH=2Ag↓+ (NH4)2CO3+2NH3
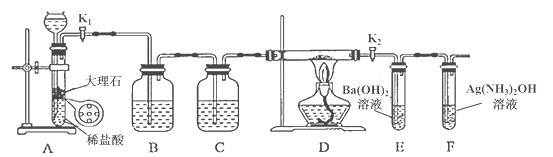
回答下列问题:
(1)B中的溶液为______________。
(2)先称量硬质玻璃管的质量为ml g,将样品装入硬质玻璃管中,称得样品和硬质玻璃管的总质量是m2 g。再进行下列实验操作,其正确顺序是____________(填标号);重复上述操作步骤,直至硬质玻璃管恒重,称得质量为m3 g。
a.点燃酒精灯,加热 b.熄灭酒精灯 c.称量硬质玻璃管
d.打开K1和K2,通入CO2至E中出现浑浊 e.关闭K1和K2 f.冷却到室温
(3)加热硬质玻璃管一段时间,观察到以下现象:
①钠块表面变暗,熔融成金属小球;
②继续加热,钠迅速燃烧,产生黄色火焰。反应完全后,管中有大量黑色物质;
③F中试管内壁有银白物质产生。
产生上述②现象的原因是____________________________________________________;
(4)探究固体产物中钠元素的存在形式
假设一:只有Na2CO3; 假设二:只有Na2O; 假设三:Na2O和Na2CO3均有;
完成下列实验设计,验证上述假设:
步骤 | 操作和现象 | 结论 |
1 | 将硬质玻璃管中的固体产物溶于水后过滤; | 假设一成立 |
2 | 往步骤1所得滤液中_________________________________; 现象:____________________________________。 |
(5)根据上述实验现象及下表实验数据,写出Na与CO2反应的总化学方程式_____________。
m1 | m2 | m3 |
66.7g | 69.0g | 72.1g |