题目内容
【题目】硫和钒的相关化合物,在药物化学及催化化学等领域应用广泛。回答下列问题:
(1)基态钒原子的外围电子轨道表达式为___________,钒有+2、+3、+4、+5等多种化合价,其中最稳定的化合价是________,VO43-的几何构型为________.
(2)2-巯基烟酸氧钒配合物(图1) 是副作用小的有效调节血糖的新型药物。

①基态S原子中原子核外未成对电子数为_______,该药物中S原子的杂化方式是_______.所含第二周期元素第一电离能按由大到小顺序的排列是___________.
②2-巯基烟酸(图2) 水溶性优于2-巯基烟酸氧钒配合物的原因是_________.
(3)多原子分子中各原子若在同一平面,且有相互平行的p轨道,则p电子可在多个原子间运动,形成“离域Π键”,下列物质中存在“离域Π键”的是_____.
A.SO2 B.SO42- C.H2S D.CS2
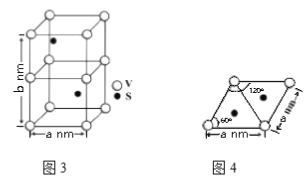
(4)某六方硫钒化合物晶体的晶胞如图3所示,该晶胞的化学式为______。图4 为该晶胞的俯视图,该晶胞的密度为________g/cm3 (列出计算式即可)。
【答案】 ![]() +5 正四面体 2 sp3 N>O>C 2-巯基烟酸的羧基可与水分子之间形成氢键,使其在水中溶解度增大 AD VS
+5 正四面体 2 sp3 N>O>C 2-巯基烟酸的羧基可与水分子之间形成氢键,使其在水中溶解度增大 AD VS ![]()
【解析】(1)钒原子为23号元素,电子排布式为[Ar]3d34s2,所以外围电子轨道排布式为![]() 。其最稳定的化合价应该是+5,即失去所有的价电子,形成最外层8电子的稳定结构。根据价层电子对互斥原理,VO43-中的中心原子V的价电子为5,配位原子O不提供电子,带有三个单位负电,所以外层电子为8个,共4对,空间构型为正四面体。
。其最稳定的化合价应该是+5,即失去所有的价电子,形成最外层8电子的稳定结构。根据价层电子对互斥原理,VO43-中的中心原子V的价电子为5,配位原子O不提供电子,带有三个单位负电,所以外层电子为8个,共4对,空间构型为正四面体。
(2)①S原子的电子排布为[Ne]3s23p4,所以S原子的3p能级上有4个电子,分配在三个轨道中,有两个单电子。从图中得到S的配位数为2,所以此时S的外层有6+2=8个电子,电子对为4,所以S应该的杂化方式是sp3杂化。其中含有的第二周期元素是C、N、O。同周期元素从左向右应该是第一电离能增大,因为N的2p能级上有3个电子,是p能级的半满稳定结构,所以N的第一电离能反常增大,所以第一电离能为:N>O>C。
②2-巯基烟酸有羧基可以与水分子形成氢键,所以其水溶性会更好。
(3)从题目表述来看,形成离域Π键的要求是:①原子共平面;②有相互平行的p轨道。根据价层电子对互斥理论,二氧化硫为平面三角形,硫酸根为正四面体,硫化氢为角型,二硫化碳为直线型。所以选项B一定错误。而硫化氢的H原子不存在p轨道。所以选项C错误。由上正确的是选项A和选项D。
(4)晶胞中有V为:8×1/8+4×1/4=2个;S为:2×1=2个,所以化学式为VS。因为该晶胞中有2个VS,所以晶胞质量为2×(32+51)/NA g。根据图4得到晶胞底面的面积为a×![]() nm2,所以晶胞的体积为:a×
nm2,所以晶胞的体积为:a×![]() ×b nm3。1nm=10-7cm,所以晶体密度为
×b nm3。1nm=10-7cm,所以晶体密度为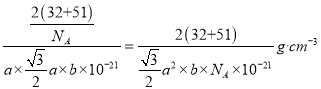 。
。

 鸿图图书寒假作业假期作业吉林大学出版社系列答案
鸿图图书寒假作业假期作业吉林大学出版社系列答案【题目】从化学键的角度分析,化学反应的过程就是反应物的化学键的断裂和生成物的化学键的形成过程。已知键能数据如下表:
化学键 | N≡N | N—H | H—H |
键能(kJ/mol) | 942 | 391 | b |
反应N2(g)+3H2(g) ![]() 2NH3(g);△H=-93kJ·mol-1。试根据表中所列键能数据计算b数值:( )
2NH3(g);△H=-93kJ·mol-1。试根据表中所列键能数据计算b数值:( )
A.551
B.437
C.558
D.160
【题目】四种短周期元素在周期表中的相对位置如图所示,其中Z元素原子核外电子总数是其最外层电子数的3倍。
X | Y | |
Z | W |
请回答下列问题:
(1)元素Z位于周期表中第_________周期_________族;
(2)这些元素的氢化物中,水溶液碱性最强的是_________(写化学式);
(3)XW2的电子式为_________;
(4)Y的最高价氧化物的化学式为_________。