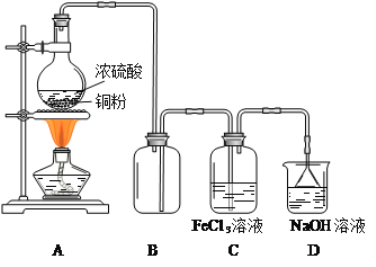
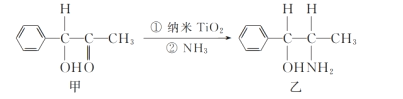
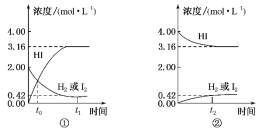
题目内容
【题目】为防治含硫煤燃烧产生的大气污染,某工厂设计了新的治污方法,工艺流程如图所示。下列叙述错误的是( )
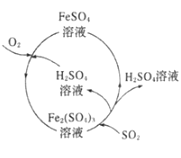
A.该流程可以除去煤燃烧时产生尾气中的SO2,变废为宝
B.该流程中H2SO4和Fe2(SO4)3溶液可以循环利用
C.流程中每吸收11.2LSO2(标准状况)同时产生1molFe2+
D.流程中涉及的Fe2+被氧化的反应的离子方程式为4Fe2++O2+2H2O═4Fe3++4OH-
【答案】D
【解析】
A. 由工艺流程图可知,该流程SO2、氧气和水反应生成硫酸,故A正确;
B. 由工艺流程图可知,该流程中H2SO4和Fe2(SO4)3可以循环利用,故B正确;
C.该流程中,硫元素化合价由+4升高为+6、铁元素化合价由+3降低为+2,每吸收11.2LSO2(标准状况)同时产生1molFe2+,故C正确;
D.该流程为酸性环境,流程中涉及的Fe2+被氧化的反应的离子方程式为4Fe2++O2+4H+═4Fe3++2H2O,故D错误。

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】高炉炼铁过程中发生反应: ![]() Fe2O3(s)+CO(g)
Fe2O3(s)+CO(g)![]()
![]() Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
Fe(s)+CO2(g),该反应在不同温度下的平衡常数见右表。下列说法正确的是( )
温度T/℃ | 1000 | 1150 | 1300 |
平衡常数K | 4.0 | 3.7 | 3.5 |
A. 由表中数据可判断该反应:反应物的总能量<生成物的总能量
B. 1000℃下Fe2O3与CO反应,t min达到平衡时c(CO) =2×10-3 mol/L,则用CO2表示该反应的平均速率为2×10-3/t mol·L-1·min-1
C. 为了使该反应的K增大,可以在其他条件不变时,增大c(CO)
D. 其他条件不变时,增加Fe2O3的用量,不能有效降低炼铁尾气中CO的含量