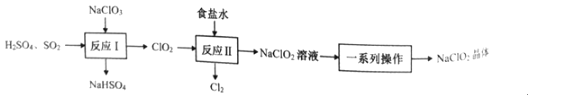
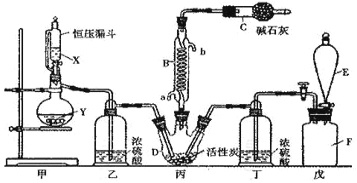
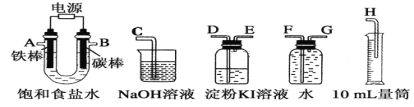
题目内容
【题目】利用如图所示装置进行实验,不能达到相应实验目的的是( )
A.利用装置①分离Fe(OH)3胶体和FeCl3溶液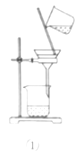
B.利用装置②干燥、收集氨气并吸收多余的氨气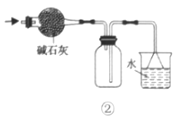
C.利用装置③收集NO2气体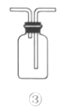
D.利用装置④证明Cl2易与NaOH溶液反应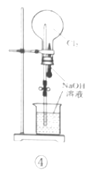
【答案】A
【解析】
A.Fe(OH)3胶体和FeCl3溶液都能透过半透膜,不能用过滤法分离,故A不能达到相应实验目的;
B.氨气是密度比空气小的碱性气体,用碱石灰干燥,用向下排空气法收集,故B能达到相应实验目的;
C.NO2的密度大于空气,用向上排空气法收集, 利用装置③从长导管进气可以收集NO2气体,故C能达到相应实验目的;
D.氯气和氢氧化钠溶液反应生成氯化钠和次氯酸钠,气体体积减小,形成喷泉,利用装置④能证明Cl2易与NaOH溶液反应,故D能达到相应实验目的;
故选A。

 百强名校期末冲刺100分系列答案
百强名校期末冲刺100分系列答案 好成绩1加1期末冲刺100分系列答案
好成绩1加1期末冲刺100分系列答案 金状元绩优好卷系列答案
金状元绩优好卷系列答案【题目】某温度下,SO2和O2发生反应:2SO2(g)+O2(g)=== 2SO3(g),SO2的浓度随反应时间(t)的变化如下表。在0~10 s内,平均反应速率为( )
t/s | 0 | 5 | 10 | 15 |
SO2/(mol·L-1) | 0.82 | 0.40 | 0.32 | 0.28 |
A.v(SO2)=0.032 mol·L-1B.v(SO2)=0.050 mol·L-1
C.v(SO2)=0.050 mol·L-1·s-1D.v(SO2)=0.032 mol·L-1·s-1
【题目】下列根据实验操作、现象得出相应结论一定正确的是
选项 | 实验操作、现象 | 实验结论 |
A | 用pH计测定同浓度NaF溶液和CH3COONa溶液: pH(NaF)<pH(CH3COONa) | 酸性:HF>CH3COOH |
B | 向2mL 0.5mol/L FeCl3溶液中滴加2mL 1mol/L KSCN溶液,振荡后静置,观察到溶液变成红色,加入1mL 2mol/L KCl溶液后溶液红色变浅 | c(KCl)增大使该反应 FeCl3+3KSCN 的化学平衡逆向移动 |
C | 向盛有2ml0.1mol·L-1AgNO3的试管中滴加5滴0.1mol·L-1NaCl溶液,出现白色沉淀;再往试管中滴加5滴0.1mol·L-1KI溶液,出现黄色沉淀 | KSP(AgCl)>KSP(AgI) |
D | 将10mL2mol/L FeCl3的溶液与1mL1mol/LKI溶液混合充分反应后滴加KSCN,溶液颜色变红 | KI与FeCl3反应有可逆性 |
A.AB.BC.CD.D
【题目】下表是元素周期表的一部分,针对表中的①~⑩种元素,请用化学用语回答下列问题:
族 周期 | IA | IIA | IIIA | IVA | VA | VIA | VIIA | 0 |
2 | ⑥ | ⑦ | ⑧ | |||||
3 | ① | ③ | ⑤ | ⑨ | ⑩ | |||
4 | ② | ④ |
(1)在③~⑦元素中,原子半径最大的是__________(填元素符号);
(2)⑦元素的最高价氧化物对应的水化物与其氢化物能生成盐M,M中含有的化学键类型有__________________;
(3)写出元素①和⑧的单质在加热条件下反应生成的化合物的电子式:_________。
(4
(5)①~⑨中元素最高价氧化物对应的水化物中酸性最强的是_____________(填物质化学式);呈两性的氢氧化物是_________(填物质化学式),该化合物与NaOH溶液反应的离子方程式为___________。
(6)用电子式表示元素③与⑨形成化合物的过程_____________________________。