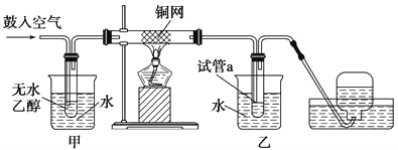
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(1)请用双线桥法标出电子转移方向和数目___。
(2)上述反应中氧化剂是___(填化学式),被氧化的元素是___(填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是___(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为___L。
(5)下列离子方程式的书写及评价均合理的是___。
选项 | 离子方程式 | 评价 |
A | 将1molCl2通入含1molFeI2溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | 1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3 |
C | 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | Ca(HCO3)2溶液与足量的NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
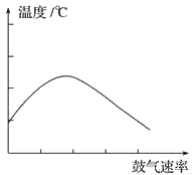
(6)将一定量Mg、Al合金溶于1mol·L-1的HC1溶液中,进而向所得溶液中滴加1mol·L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。下列结论中正确的是___。
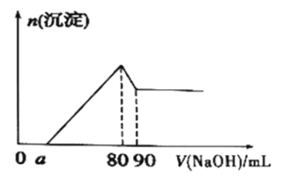
A.溶解“一定量Mg、A1合金”的HC1溶液的体积为90mL
B.Al的物质的量为0.01mol
C.可算出实验中产生H2的物质的量为0.04mol
D.若a=20,可算出Mg的物质的量为0.04mol
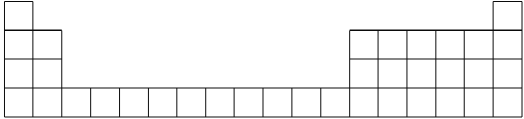
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中所对应的位置(以下为周期表的一部分)_________。
(2)画出A的原子结构示意图_________。
(3)B元素处于周期表中第________周期,________族。
(4)E元素处于周期表中第________周期,________族。
(5)C、D的简单离子的半径由大到小顺序为________(用离子符号表示)。
(6)上述五种元素的最高价氧化物对应的水化物中酸性最强的是__________(填化学式)。
(7)C、E形成的化合物为________(填化学式)。
(8)写出B单质和氢氧化钠溶液反应的方程式__________写出B的最高价氧化物对应水化物和氢氧化钠溶液反应的离子方程式:________