题目内容
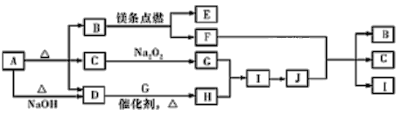
【题目】某研究所对含硫酸亚铁和硫酸铜的工业废料进行相关的研究。实验过程如下:
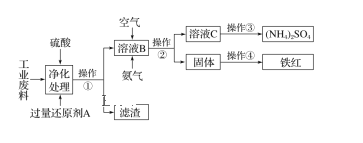
回答下列问题:
(1)滤渣的成分为______________,操作②的名称为____________。
(2)上图溶液B中所发生反应的离子方程式为_________________________________。
(3)实验要求先向溶液B中通入过量的空气,证明通入空气过量的方法是___________________
(4)操作③第一步需要的仪器除了酒精灯、铁架台外,还需要____________________________。
(5)某同学利用下面装置制备氢气并利用氢气还原某金属氧化物,根据要求回答问题。
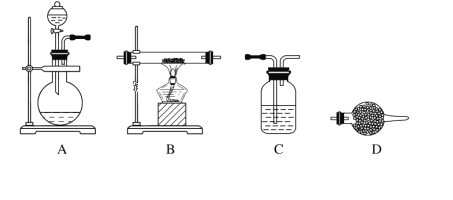
①请设计一个实验方案验证H2的还原性并检验其氧化产物,其装置连接顺序是A→________→________→________→D(除D装置外,其他装置不能重复使用),最后D装置中所加药品为________,其作用是_______________________________。
【答案】Fe、Cu 过滤 4Fe2++O2+8NH3+10H2O===8NH4++4Fe(OH)3↓ 取上层清液少许于试管中,加入酸性高锰酸钾溶液,酸性高锰酸钾溶液的紫色不变 蒸发皿、玻璃棒 C B D 碱石灰 防止空气中的水蒸气进入前面装置中
【解析】
含硫酸亚铁和硫酸铜的工业废料,结合流程可知,过量还原性试剂A为Fe,置换出Cu,则操作①为过滤,滤渣中为Cu和过量的Fe;溶液B中主要含硫酸亚铁,通入空气和氨气,反应生成硫酸铵和氢氧化铁,操作②为过滤,固体为氢氧化铁,操作④为加热,生成红色的氧化铁;溶液C为硫酸铵溶液,则操作③为蒸发结晶得到硫酸铵晶体,然后结合氢气还原金属氧化物时,先通入氢气后加热,试管冷却后再停止通入氢气来解答。
含硫酸亚铁和硫酸铜的工业废料,结合流程可知,过量还原性试剂A为Fe,置换出Cu,则操作①为过滤,滤渣中为Cu和过量的Fe;溶液B中主要含硫酸亚铁,通入空气和氨气,反应生成硫酸铵和氢氧化铁,操作②为过滤,固体为氢氧化铁,操作④为加热,生成红色的氧化铁;溶液C为硫酸铵溶液,则操作③为蒸发结晶得到硫酸铵晶体。
(1)由上述分析可知,滤渣为Fe、Cu,操作①为过滤,故答案为Fe、Cu;过滤;
(2)B中所发生反应的离子方程式为4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓,故答案为4Fe2++O2+8NH3+10H2O=8NH4++4Fe(OH)3↓;
(3)向溶液B中通入过量的空气,证明通入空气过量,即亚铁离子不存在,其方法是取上层清液少许于试管中,加入酸性高锰酸钾溶液,酸性高锰酸钾溶液的紫色不变(无变化),故答案为取上层清液少许于试管中,加入酸性高锰酸钾溶液,酸性高锰酸钾溶液的紫色不变;
(4)操作③为蒸发结晶,还需要的仪器为蒸发皿、玻璃棒,故答案为蒸发皿,玻璃棒;
(5)根据验证H2的还原性并检验其氧化产物,装置顺序依次为制取氢气装置A、干燥氢气装置C、还原金属氧化物B、检验还原产物D、吸收空气中的水分装置D,连接顺序为:A-C-B-D-D,D装置中所加药品碱石灰,其作用为防止空气中水蒸气进入前面装置中,故答案为C,B,D,碱石灰,防止空气中水蒸气进入前面装置中。

 时刻准备着暑假作业原子能出版社系列答案
时刻准备着暑假作业原子能出版社系列答案 暑假衔接教材期末暑假预习武汉出版社系列答案
暑假衔接教材期末暑假预习武汉出版社系列答案 假期作业暑假成长乐园新疆青少年出版社系列答案
假期作业暑假成长乐园新疆青少年出版社系列答案