题目内容
【题目】元素周期表是学习化学的重要工具,它隐含着许多信息和规律。下表所列是五种短周期元素的原子半径及主要化合价(已知铍的原子半径为0.089 nm)。
元素代号 | A | B | C | D | E |
原子半径/nm | 0.16 | 0.143 | 0.102 | 0.099 | 0.074 |
主要化合价 | +2 | +3 | +6、-2 | -1 | -2 |
(1)用元素代号标出它们在周期表中所对应的位置(以下为周期表的一部分)_________。
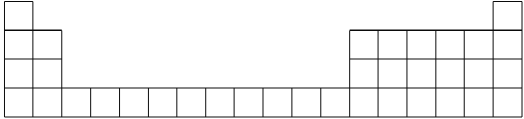
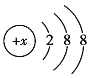
(2)画出A的原子结构示意图_________。
(3)B元素处于周期表中第________周期,________族。
(4)E元素处于周期表中第________周期,________族。
(5)C、D的简单离子的半径由大到小顺序为________(用离子符号表示)。
(6)上述五种元素的最高价氧化物对应的水化物中酸性最强的是__________(填化学式)。
(7)C、E形成的化合物为________(填化学式)。
(8)写出B单质和氢氧化钠溶液反应的方程式__________写出B的最高价氧化物对应水化物和氢氧化钠溶液反应的离子方程式:________
【答案】具体位置如下:
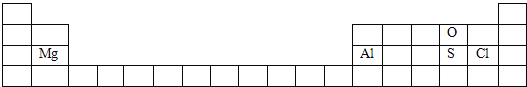
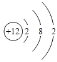 三 ⅢA 二 ⅥA S2->Cl- HClO4 SO2、SO3 2Al+ 2NaOH + 6H2O=2Na[Al(OH) 4] + 3H2↑(或2Al+ 2NaOH + 2H2O=2NaAlO2+ 3H2↑) Al(OH)3 + OH-=[Al (OH) 4]- (或Al(OH)3 + OH-=AlO2-+2H2O)
三 ⅢA 二 ⅥA S2->Cl- HClO4 SO2、SO3 2Al+ 2NaOH + 6H2O=2Na[Al(OH) 4] + 3H2↑(或2Al+ 2NaOH + 2H2O=2NaAlO2+ 3H2↑) Al(OH)3 + OH-=[Al (OH) 4]- (或Al(OH)3 + OH-=AlO2-+2H2O)
【解析】
原子的电子层数越多,其原子半径越大,同一周期元素中,原子半径随着原子序数的增大而减小,铍的原子半径为0.089nm,E的原子半径小于铍且其最低负价是-2,元素的最低负价=其最外层电子数-8,所以E位于第VIA族,为O元素,这几种元素都是短周期元素,原子半径大小顺序是A>B>C>D,这几种元素的原子半径都大于铍原子,则为第三周期元素,结合其主要化合价知,A是Mg元素、B是Al元素、C是S元素、D是Cl元素,据此分析作答。
根据上述分析可知,A是Mg元素、B是Al元素、C是S元素、D是Cl元素、E为O元素。
(1)O元素位于第二周期第VIA族、Mg元素位于第三周期第IIA族、Al元素位于第三周期第IIIA族、S元素位于第三周期第VIA族、Cl元素位于第三周期第VIIA族,所以其在周期表中的位置为 ,
,
(2)A为Mg元素,其核电荷数为12,原子的结构示意图为: ;
;
(3)B元素原子核外电子层数等于其周期数,其最外层电子数等于其族序数,Al原子核外有3个电子层,最外层有3个电子,所以铝元素位于第三周期IIIA族;
(4)E为O元素,位于元素周期表第二周期ⅥA族;
(5)S2-和Cl-核外电子数均为18,因电子层数相同的微粒,核电荷数越大半径越小,则简单离子半径比较:S2->Cl-;
(6)最高价氧化物对应水化物分别为Mg(OH)2、Al(OH)3、H2SO4、HClO4,元素的非金属性越强,其最高价氧化物的水化物的酸性越强,但O元素没有正化合价,其次非金属性强的是Cl元素,所以酸性最强的酸是HClO4,
故答案为:HClO4;
(7)c为硫,E为氧,二者可以形成二氧化硫、三氧化硫,化学式:SO2、SO3,故答案为:SO2、SO3;
(8)Al单质和氢氧化钠溶液反应会生成四羟基合铝(或偏铝酸钠)与氢气,方程式为:2Al+ 2NaOH + 6H2O=2Na[Al(OH) 4] + 3H2↑(或2Al+ 2NaOH + 2H2O=2NaAlO2+ 3H2↑);
B的最高价氧化物对应水化物为氢氧化铝,它和氢氧化钠溶液反应的离子方程式为:Al(OH)3 + OH-=[Al (OH) 4]- (或Al(OH)3 + OH-=AlO2-+2H2O)。

 阅读快车系列答案
阅读快车系列答案