题目内容
【题目】储氢纳米碳管的研究成功体现了科技的进步,但用电弧法合成的碳纳米管常伴有大量的杂质——碳纳米颗粒,这种碳纳米颗粒可用氧化气化法提纯。其反应式为:3C+2K2Cr2O7+8H2SO4=3CO2↑+2K2SO4+2Cr2(SO4)3+8H2O。
(1)请用双线桥法标出电子转移方向和数目___。
(2)上述反应中氧化剂是___(填化学式),被氧化的元素是___(填元素符号)。
(3)H2SO4在上述反应中表现出来的性质是___(填序号)。
A.氧化性 B.氧化性和酸性 C.酸性 D.还原性和酸性
(4)若反应中电子转移了0.8mol,则产生的气体在标准状况下的体积为___L。
(5)下列离子方程式的书写及评价均合理的是___。
选项 | 离子方程式 | 评价 |
A | 将1molCl2通入含1molFeI2溶液中:2Fe2++2I-+2Cl2=2Fe3++4Cl-+I2 | 正确;Cl2过量,可将Fe2+、I-均氧化 |
B | 1mol·L-1的NaAlO2溶液和2.5mol·L-1的HCl溶液等体积互相均匀混合:2AlO2-+5H+=Al3++Al(OH)3↓+H2O | 正确;AlO2-与Al(OH)3消耗的H+的物质的量之比为2∶3 |
C | 过量SO2通入NaClO溶液中:SO2+H2O+ClO-=HClO+HSO3- | 正确;说明酸性:H2SO3强于HClO |
D | Ca(HCO3)2溶液与足量的NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+H2O | 正确;酸式盐与碱反应生成正盐和水 |
(6)将一定量Mg、Al合金溶于1mol·L-1的HC1溶液中,进而向所得溶液中滴加1mol·L-1的NaOH溶液,产生沉淀的物质的量(n)与滴加的NaOH溶液(mL)体积的关系如图所示。下列结论中正确的是___。
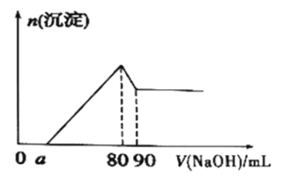
A.溶解“一定量Mg、A1合金”的HC1溶液的体积为90mL
B.Al的物质的量为0.01mol
C.可算出实验中产生H2的物质的量为0.04mol
D.若a=20,可算出Mg的物质的量为0.04mol
【答案】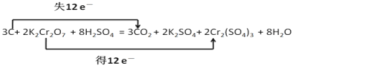 K2Cr2O7 C C 4.48L B B
K2Cr2O7 C C 4.48L B B
【解析】
(1)该反应中中C元素的化合由0升高为+4价,Cr元素的化合价由+6价降低为+3价,该反应转移12e-,则用双线桥法标出电子转移方向和数目为 ;
;
(2)氧化剂得电子化合价降低,所以K2Cr2O7为氧化剂;被氧化的元素化合价应升高,所以C元素被氧化;
(3)该反应中硫酸反应生成盐和水,所以表现酸性,所以选C;
(4)根据双线桥可知转移0.8mol电子时生成二氧化碳的物质的量为0.2mol,标况下体积为4.48L;
(5)A.将1molCl2通入到含1molFeI2溶液中,氯气量不足,碘离子还原性强于二价铁离子,氯气先氧化碘离子,离子方程式:2I-+Cl2=2Cl-+I2,故A错误;
B.1mol/L的NaAlO2溶液和2.5mol/L的HCl溶液等体积互相均匀混合反应方程式为:2AlO2-+5H+=Al3++Al(OH)3↓+2H2O,1mol偏铝酸根离子消耗1mol氢离子生成1mol氢氧化铝沉淀,剩余的1.5mol氢离子溶解0.5mol氢氧化铝沉淀,则AlO2-与Al(OH)3消耗的H+的物质的量之比为1mol:1.5mol=2:3,故B正确;
C.过量SO2通入到NaClO溶液中,SO32-有强还原性,ClO-有强氧化性,发生氧化还原反应,正确的离子方程式为:SO2+H2O+ClO-=2H++SO42-+Cl-,故C错误;
D.Ca(HCO3)2溶液与足量的NaOH溶液反应,离子方程式:Ca2++2HCO3-+OH-=CaCO3↓+2H2O+CO32-,故D错误;
综上所述选B;
(6)A.滴加80mLNaOH溶液时沉淀量达到最大,此时沉淀为Al(OH)3和Mg(OH)2,溶液中的溶质为NaCl,则n(HCl)=n(Cl-)=n(Na+)=0.08L×1mol/L=0.08mol,HCl溶液的浓度为1mol/L,所以HCl溶液的体积为80mL,故A错误;
B.80~90mL发生反应Al(OH)3+OH-=AlO2-+2H2O,根据元素守恒可知n(Al)=0.01L×1mol/L=0.01mol,故B正确;
C.根据已知条件无法确定Mg的量,则无法确定金属溶解时消耗的HCl的量,所以产生H2的物质的量不确定,故C错误;
D.a~80mL发生反应:Mg2++2OH-=Mg(OH)2↓、Al3++3OH-=Al(OH)3↓,铝离子消耗的NaOH的体积为![]() =0.03L=30mL,a=20,则镁离子消耗的NaOH的体积为80mL-20mL-30mL=30mL,所以n(Mg)=0.03L×1mol/L×
=0.03L=30mL,a=20,则镁离子消耗的NaOH的体积为80mL-20mL-30mL=30mL,所以n(Mg)=0.03L×1mol/L×![]() =0.015mol,故D错误;
=0.015mol,故D错误;
综上所述选B。

 中考解读考点精练系列答案
中考解读考点精练系列答案【题目】二氯化二硫(S2Cl2)是一种重要的化工原料,常用作橡胶硫化剂,改变生橡胶受热发粘、遇冷变硬的性质。查阅资料可知S2Cl2具有下列性质:
物理性质 | 毒性 | 色态 | 挥发性 | 熔点 | 沸点 |
剧毒 | 金黄色液体 | 易挥发 | -76℃ | 138℃ | |
化学性质 | ①300 ℃以上完全分解 ②S2Cl2+Cl2 ③遇高热或与明火接触,有引起燃烧的危险 ④受热或遇水分解放热,放出腐蚀性烟气 | ||||
(1)制取少量S2Cl2
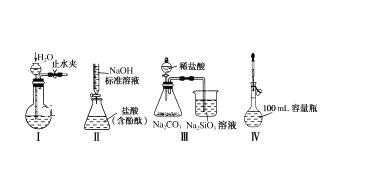
实验室可利用硫与少量氯气在110~140℃反应制得S2Cl2粗品,氯气过量则会生成SCl2。

①仪器m 的名称为__________,装置F 中试剂的作用是_________。
②装置连接顺序: A![]() ______
______![]()
![]()
![]() E
E![]() D。
D。
③实验前打开K1,通入一段时间的氮气排尽装置内空气。实验结束停止加热后,再通入一段时间的氮气,其目的是_____________。
④为了提高S2Cl2的纯度,实验的关键是控制好温度和____________。
(2)少量S2Cl2泄漏时应喷水雾减慢其挥发(或扩散),并产生酸性悬浊液,但不要对泄漏物或泄漏点直接喷水,其原因是______________。
(3)S2Cl2遇水会生成SO2、HCl两种气体,某同学设计了如下实验方案来测定该混合气体中SO2的体积分数。

①W溶液可以是_____(填标号)。
a.H2O2溶液 b.KMnO4溶液(硫酸酸化) c.氯水
②该混合气体中二氧化硫的体积分数为_________(用含V、m 的式子表示)。