【题目】硫和氮的氧化物直接排放会引发严重的环境问题,请回答下列问题:
Ⅰ.SO2的排放主要来自于煤的燃烧。常用石灰石脱硫,其产物可以做建筑材料。
已知:CaCO3(s)=CO2(g)+CaO(s) ΔH=+178.2kJ/mol
SO2(g)+CaO(s)=CaSO3(s) ΔH=-402kJ/mol
2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-234.2kJ/mol
写出石灰石脱硫的热化学反应方程式___________________________。
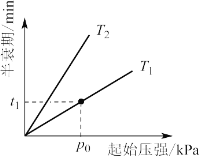
Ⅱ.在一定温度下的恒容容器中,反应2N2O(g)=2N2(g)+O2(g)的部分实验数据如下:
反应时间/min | 0 | 10 | 20 | 30 | 40 | 50 | 60 | 70 | 80 | 90 | 100 |
c(N2O) /mol·L-1 | 0.100 | 0.090 | 0.080 | 0.070 | 0.060 | 0.050 | 0.040 | 0.030 | 0.020 | 0.010 | 0.000 |
①在0~20min 时段,反应速率υ(N2O)为_____。
②若N2O起始浓度c0为0.150mol·L-1,则反应至30min时N2O的转化率α=____,比较不同起始浓度时N2O的分解速率:υ(c0=0.150mol·L-1)____υ(c0=0.100 mol·L-1)(填“>、=或<”)
③不同温度(T)下,N2O分解半衰期随起始压强的变化关系如图所示(图中半衰期指任一浓度N2O耗一半时所需的相应时间),则T1__T2(填“>、=或<”)。当温度为T1、起始压强为p0,反应至t1min时,体系压强p=__(用 p0表示)。