题目内容
【题目】氮化铝(AlN)是一种新型无机材料,工业上由氧化铝与焦炭在氮气流中高温制得,产品中常含有Al4C3、C和Al2O3等杂质。某实验小组为测定a g工业氮化铝样品中AlN的质量及Al4C3的质量分数,设计了如下装置,已知装置B、C、D中的药品均足量。
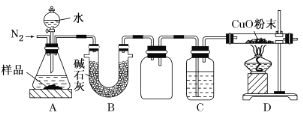
已知:①AlN和Al4C3均能与水反应,分别生成NH3和CH4。②CH4能与CuO发生反应:CH4+4CuO![]() 4Cu+CO2+2H2O。
4Cu+CO2+2H2O。
(1)写出锥形瓶中发生反应的化学方程式。AlN与H2O反应:__________;Al4C3与H2O反应:____________。
(2)有下列操作步骤:①缓缓鼓入一定量的N2;②称量C和D(酒精灯和铁架台等除外)的质量,按顺序组装仪器,检查装置的气密性,将样品放入锥形瓶中;③点燃D处酒精灯;④再次称量C和D的质量;⑤从分液漏斗缓缓滴入水,直到不再产生气体时为止;⑥再次缓缓鼓入一定量的N2。正确的操作顺序是_________。
(3)C的作用是吸收氨气,则C中所盛试剂的最佳选择是________(填代号)。
A.蒸馏水 B.浓硝酸C.浓盐酸 D.浓硫酸
(4)A中反应结束后,还要通入一段时间的N2至D中固体恢复到室温,其目的是_______(写两条)。
(5)实验结束后,测得反应后D中固体质量减少m g,C中增加n g,则a g样品中AlN的质量为________g,Al4C3的质量分数为________×100%。
【答案】AlN+3H2O=Al(OH)3+NH3↑ Al4C3+12H2O=4Al(OH)3+3CH4↑ ②①③⑤⑥④ D 使生成的甲烷充分反应或生成的氨气完全被吸收或防止高温下铜与空气中的氧气反应,重新生成氧化铜 ![]() (或2.41n)
(或2.41n)![]()
![]()
【解析】
(1)依据已知条件AlN和Al4C3均能与水反应,分别生成NH3和CH4,结合水解原理作答;
(2)依据实验原理分析作答;
(3)氨气为碱性气体,需用酸性吸收剂,结合各物质物理性质分析;
(4)继续通入氮气,可使气体充分吸收,同时可防止氧气干扰实验;
(5)根据C中增重计算AlN的质量,根据D中质量差和方程式计算Al4C3的质量分数。
(1)AlN和Al4C3均能与水反应,分别生成NH3和CH4,则AlN与H2O反应生成氢氧化铝与氨气,其化学方程式为:AlN+3H2O=Al(OH)3+NH3↑;Al4C3与H2O反应生成氢氧化铝与甲烷,其化学方程式为:Al4C3+12H2O=4Al(OH)3+3CH4↑;
(2)由题意可知该实验的原理是:根据装置C的增重测定生成NH3的量,通过D中氧化铜粉末的质量变化测定CH4的量,实验前,首先称量C和D的质量,其次通入氮气排空气,再次点燃D处酒精灯,然后使样品与水反应,生成的氨气被C吸收,甲烷与氧化铜发生反应,最后,再通入氮气,使装置内的气体充分反应或被吸收,同时避免生成的铜重新被氧化,再次称量C和D的质量,所以正确的操作顺序为②①③⑤⑥④;
(3)浓硝酸和浓盐酸易挥发,会造成质量误差,所以B、C项错误;氨气虽然极易溶于水,但氨水易挥发,会造成质量误差,挥发出的氨气和水蒸气都会对D中实验造成干扰,A项错误;浓硫酸可吸收氨气,达到实验目的,D项正确;
故答案选D;
(4)A中反应结束后,还要通入一段时间的N2至D中固体恢复到室温,主要是为了使生成的甲烷充分反应或生成的氨气完全被吸收或防止高温下铜与空气中的氧气反应,重新生成氧化铜;
(5)装置C增加的质量即为氨气的质量,ng氨气的物质的量为![]() ,则根据N守恒,AlN的物质的量亦为
,则根据N守恒,AlN的物质的量亦为![]() ,质量为
,质量为![]() ×41g/mol=
×41g/mol=![]() (或2.41n)g;根据CH4+4CuO
(或2.41n)g;根据CH4+4CuO![]() 4Cu+CO2+2H2O和D中固体质量减少mg,可求得消耗CH4的物质的量为
4Cu+CO2+2H2O和D中固体质量减少mg,可求得消耗CH4的物质的量为![]() ,则根据C守恒,ag样品中含Al4C3的物质的量为
,则根据C守恒,ag样品中含Al4C3的物质的量为![]() ,其质量为
,其质量为![]() mol×144g/mol=
mol×144g/mol=![]() g,其质量分数为
g,其质量分数为![]() ×100%,故答案为:
×100%,故答案为:![]() (或2.41n);
(或2.41n);![]() 。
。

 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案