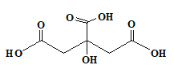
题目内容
【题目】(1)按图装置进行实验。请回答下列问题:

①以下叙述错误的是_______________(填字母)。
A.铜片是正极,表面有气泡产生
B.装置中存在“化学能→电能→光能”的转化
C.外电路中电流方向Zn→Cu
D.溶液中SO42-向铜片方向移动
②实验发现不仅在铜片上有气泡产生,在锌片上也有气泡产生。分析锌片上产生气泡的原因是_______________________。
③实验中当负极材料消耗质量为2.6g时,则电路中转移电子数为___________。
(2)某种燃料电池的工作原理示意如图所示,a、b均为惰性电极。

①电池工作时,空气从_____口通入(填“A”或“B”);
②若使用的燃料为氢气(H2),a极的电极反应式为_____________________。
【答案】CD 锌与稀硫酸直接反应生成了氢气 0.08NA B H2-2e-+2OH-=4H2O
【解析】
(1)该装置为原电池装置,电池总反应为Zn+H2SO4=ZnSO4+H2↑,所以Zn为负极,Cu为正极;
(2)根据电子的流向可知a为负极,b为正极。
(1)①A.根据分析可知铜片为正极,氢离子得电子生成氢气,所以有气泡生成,故A正确;
B.原电池可以将化学能转化为电能,电能通过LED灯转化为光能,故B正确;
C.外电路中电流由正极流向负极,即Cu→Zn,故C错误;
D.电解质溶液中阴离子流向负极,所以硫酸根流向锌片,故D错误;
综上所述选CD;
②锌与稀硫酸直接反应生成了氢气,所以锌片上也产生气泡;
③负极发生Zn-2e-=Zn2+,2.6g锌的物质的量为![]() =0.04mol,根据电极方程式可知转移的电子数为0.08NA;
=0.04mol,根据电极方程式可知转移的电子数为0.08NA;
(2)①燃料电池中,氧气发生还原反应,为正极,所以空气从B口通入;
②若燃料为氢气,则氢气发生氧化反应,A口通入a极反应,电解质溶液为碱性,所以电极反应式为H2-2e-+2OH-=4H2O。