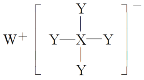题目内容
【题目】酮洛芬是一种良好的抗炎镇痛药,可以通过以下方法合成:
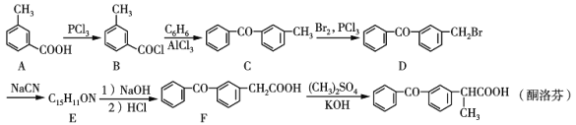
(1)化合物D中所含官能团的名称为___和____。
(2)化合物E的结构简式为__________;由B→C的反应类型是____
(3)写出C→D的反应方程式:_____________________。
(4)B的同分异构体有多种,其中同时满足下列条件的有____种。
Ⅰ.属于芳香族化合物 Ⅱ.能发生银镜反应Ⅲ.其核磁共振氢谱有5组峰,且面积比为1∶1∶1∶1∶3
【答案】羰基(酮基) 溴原子 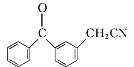 取代反应
取代反应 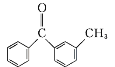 +Br2
+Br2![]()
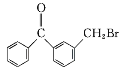 +HBr 10
+HBr 10
【解析】
A转化为B,-COOH转化为-COCl,B与苯发生取代反应生成C,C与Br2发生取代反应生成D,根据F与D的结构简式可知, D中-Br被-CN取代生成E,推出E的结构简式为: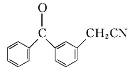 ,E发生水解反应生成F,F发生取代反应生成酮洛芬,据此分析作答。
,E发生水解反应生成F,F发生取代反应生成酮洛芬,据此分析作答。
(1)化合物D(![]() )中所含官能团的名称为羰基(酮基)和溴原子;
)中所含官能团的名称为羰基(酮基)和溴原子;
(2) 对比D、F结构,结合E的分子式,可知D中-Br被-CN取代生成E,则E的结构简式为: ;对比B、C结构简式可知,B中-Cl为苯基取代生成C,同时还生成HCl,由B→C的反应类型是取代反应,故答案为:
;对比B、C结构简式可知,B中-Cl为苯基取代生成C,同时还生成HCl,由B→C的反应类型是取代反应,故答案为: ;取代反应;
;取代反应;
(3)比C、D的结构可知,C中甲基上H原子被Br原子取代生成D,属于取代反应,故其反应方程式为: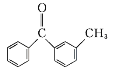 +Br2
+Br2![]()
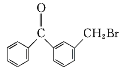 +HBr;
+HBr;
(4)B的同分异构体属于芳香族化合物说明含有苯环,能发生银镜反应,说明分子结构中存在醛基;分子中含有其核磁共振氢谱有5组峰,说明分子结构中存在5种不同化学环境的氢原子,且面积比为1:1:1:1:3,说明苯环侧链上含有3个,根据定二移一原则,符合条件的同分异构体有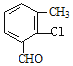 、
、![]() 、
、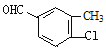 、
、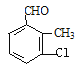 、
、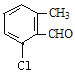 、
、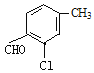 、
、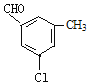 、
、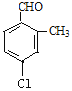 、
、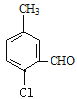 、
、 共有10种同分异构体,故答案为:10。
共有10种同分异构体,故答案为:10。

【题目】新能源汽车的核心部 件是锂离子电池,磷酸亚铁锂(LiFePO4)以其高倍率性、高比能量、高循环特征、高安全性、低成本、环保等优点而逐渐成为“能源新宠”。
[方法一]高温固相法是磷酸亚铁锂生产的主要方法。通常以亚铁盐(如FeC2O42H2O)磷酸盐和锂盐为原料,充分混匀后,在惰性气氛的保护气中先经过较低温预分解,再经过高温焙烧,研磨粉碎制成。其反应原理如下:
Li2CO3+2FeC2O42H2O+2NH4H2PO4 =2NH3↑+3CO2↑+ + +
(1)完成上述化学方程式______。
(2)理论上,反应中每转移0.15mol电子,会生成 ______gLiFePO4。
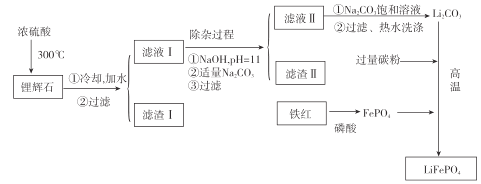
[方法二]以铁红、锂辉石LiAl(SiO3)2(含少量Ca2+、Mg2+的盐)、碳粉等原料来生产磷酸亚铁锂。其主要工艺流程如图:
已知:2LiAl(SiO3)2+H2SO4(浓)![]() Li2SO4 + Al2O34SiO2H2O↓
Li2SO4 + Al2O34SiO2H2O↓
温度/℃ | 20 | 40 | 60 | 80 |
溶解度(Li2CO3)/g | 1.33 | 1.17 | 1.01 | 0.85 |
溶解度(Li2SO4)/g | 34.2 | 32.8 | 31.9 | 30.5 |
(1)向滤液II中加入饱和Na2CO3溶液,过滤后 ,用“热水洗涤”的原因是_____。
(2)滤渣II的主要成分是_______(填化学式)。
(3)写出在高温下生成磷酸亚铁锂的化学方程式:_____________。
(4)工业上,将 Li2CO3粗品制备成高纯 Li2CO3 的部分工艺如下:
①将粗产品Li2CO3溶于盐酸作电解槽的阳极液,LiOH溶液作阴极液,两者用离子选择半透膜隔开,用惰性电极电解,阳极的电极反应式是____________。
②电解后向产品LiOH 溶液中加入过量 NH4 HCO3并加热,过滤、烘干得高纯 Li2CO3。 请写出生成Li2CO3的化学方程式:___________。