题目内容
【题目】某课外兴趣小组成员为研究金属铜与强酸的反应 ,将6.4g铜粉分为两等份,进行了如下实验,请完成有关计算。
(1)取其中一份铜粉投入200mL氢离子浓度为 1molL-1 硫酸和硝酸混合液中,微热使反应充分完成后,生成一氧化氮气体448mL(标准状况)。则反应前混合溶液中硫酸的物质的量浓度为_________(写出计算过程)。
(2)用NaOH溶液吸收氮氧化物是防止NO2污染的一种方法。原理为2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O,NO + NO2 + 2NaOH=2NaNO2 + H2O。取另一份铜粉溶于过量的硝酸溶液,假设硝酸的还原产物只有一氧化氮和二氧化氮,生成的混合气体能被amol NaOH溶液完全吸收,试讨论a的取值范围:_____。
【答案】0.45mol·L-1 a≥0.1
【解析】
(1)200mL氢离子浓度为1mol·L-1的混合液中含有氢离子的物质的量为:n(H+)=0.2L×1mol·L-1=0.2mol,
3.2g铜粉物质的量为:![]() =0.05mol,NO的物质的量为:
=0.05mol,NO的物质的量为:![]() =0.02mol,根据3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O可知,生成0.02molNO,需要铜0.03mol、H+为0.04mol,所以铜、H+过量,硝酸不足,硝酸完全反应,
=0.02mol,根据3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O可知,生成0.02molNO,需要铜0.03mol、H+为0.04mol,所以铜、H+过量,硝酸不足,硝酸完全反应,
根据氮元素守恒可知,溶液中n(HNO3)=n(NO)=0.02mol,0.02mol硝酸中含有0.02mol氢离子,则硫酸中含有的氢离子的物质的量为:0.2mol-0.02mol=0.18mol,则硫酸的物质的量浓度为: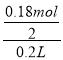 =0.45mol·L-1;
=0.45mol·L-1;
故答案为:0.45mol·L-1;
(2)0.05molCu如全生成NO,根据3Cu+8H++2NO3-=3Cu2++2NO↑+3H2O得NO为![]() =
=![]() ,0.05molCu如全生成NO2,根据Cu+4H++2NO3-=Cu2++2NO2↑+2H2O得NO2为
,0.05molCu如全生成NO2,根据Cu+4H++2NO3-=Cu2++2NO2↑+2H2O得NO2为![]() =0.1mol,根据2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O,NO + NO2 + 2NaOH=2NaNO2 + H2O,无论生成NaNO3 还是 NaNO2,Na与N的物质的量比为1:1,有1mol一氧化氮和二氧化氮的混合气体,就需要1molNaOH,生成的混合气体能被amol NaOH溶液完全吸收,a的取值范围:a≥0.1;
=0.1mol,根据2NO2 + 2NaOH=NaNO3 + NaNO2 + H2O,NO + NO2 + 2NaOH=2NaNO2 + H2O,无论生成NaNO3 还是 NaNO2,Na与N的物质的量比为1:1,有1mol一氧化氮和二氧化氮的混合气体,就需要1molNaOH,生成的混合气体能被amol NaOH溶液完全吸收,a的取值范围:a≥0.1;
故答案为:a≥0.1。