【题目】向硝酸酸化的2mL0.1molL-1AgNO3溶液(pH=2)中加入过量铁粉,振荡后静置,溶液先呈浅绿色,后逐渐呈粽黄色,试管底部仍存有黑色固体,过程中无气体生成。实验小组同学针对该实验现象进行如下探究。
Ⅰ.探究Fe2+产生的原因
(1)提出猜想:Fe2+可能是Fe与____或___反应的产物。
(2)实验探究:在两支试管中分别加入与上述实验等量的铁粉,再加入不同的液体试剂,5min后取上层清液,分别加入相同体积和浓度的铁氰化钾溶液
液体试剂 | 加人铁氰化钾溶液 | |
1号试管 | 2mL.0.1molL-1AgNO3溶液 | 无蓝色沉淀 |
2号试管 | ______ | 蓝色沉淀 |
①2号试管中所用的试剂为____。
②资料显示:该温度下,0.1molL-1的AgNO3溶液可以将Fe氧化为Fe2+。但1号试管中未观察到蓝色沉淀的原因可能为____。
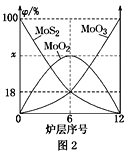
③小组同学继续进行实验,证明了2号试管得出的结论正确。实验如下:取100mL0.1molL-1硝酸酸化的AgNO3溶液(pH=2),加入铁粉井搅拌,分别插入pH传感器和NO3-传感器(传感器可检测离子浓度),得到如图图示,其中pH传感器测得的图示为___(填“图甲”或“图乙”)。
④实验测得2号试管中有NH4+生成,则2号试管中发生反应的离子方程式为___。
Ⅱ.探究Fe3+产生的原因
查阅资料可知,反应中溶液逐渐变棕黄色是因为Fe2+被Ag+氧化。小组同学设计不同实验方案对此进行验证。
(3)方案一;取出少量黑色固体,洗涤后___(填操作和现象),证明黑色固体中有Ag。
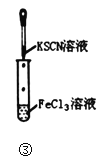
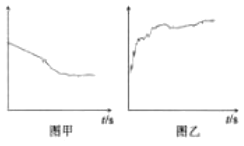
(4)方案二:按图连接装置,一段时间后取出左侧烧杯溶液,加人KSCN溶液,溶液变F红。该实验现象____(填“能“或“不能“)证明Fe2+可被Ag+氧化,理由为__。
【题目】《汉书景帝纪》记载,我国用锌的历史可追溯到西汉或更早。请回答:
(1)基态Zn原子的价层电子轨道表达式为___;占据最高能层的电子,其电子云轮廓图形状为____。
(2)与相邻元素Ga相比,元素Zn的第一电离能较大的原因为___。
(3)Zn2+可与CN-、二苯硫腙 等形成稳定配合物。
等形成稳定配合物。
①CN-的结构式为___。
②每个二苯硫腙分子中,采取sp2杂化的原子有___个。
(4)卤化锌的熔点如表所示:
ZnF2 | ZnCl2 | ZnBr2 | ZnI2 | |
熔点/℃ | 872 | 275 | 394 | 446 |
①ZnCl2、ZnBr2、ZnI2的熔点呈表中变化规律的原因____。
②ZnF2的熔点远高于其它三种卤化锌,其原因为___。
(5)ZnS的某种晶胞结构如图所示。已知该晶体的密度为dg.cm-3,S2-和Zn2+半径分别为apm、bpm,阿伏伽德罗常数的数值为NA。
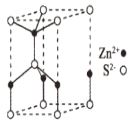
①Zn2+的配位数为___。
②该晶胞中离子的体积占晶胞体积的百分率为__(列式即可)